David A. Ricks
We're pleased with our Q1 results and the continued momentum in our business, which positions us well for accelerated growth as this year progresses. Our focus is to bring innovative medicines to people in need. And in 2024, we're investing in our people, our launches, expanding our pipeline of new medicines, including through business development, and, of course, accelerating the needed capacity in our manufacturing network.
1분기 실적과 비즈니스의 지속적인 모멘텀에 만족하며, 올해가 진행됨에 따라 성장을 가속화할 수 있는 유리한 위치에 서게 되었습니다. 우리의 초점은 도움이 필요한 사람들에게 혁신적인 의약품을 제공하는 것입니다. 그리고 2024년에는 직원과 신제품 출시, 사업 개발을 포함한 신약 파이프라인 확장에 투자하고 제조 네트워크에 필요한 역량을 가속화할 계획입니다.
Results this quarter represent a continuation of the strong growth we delivered in 2023. On Slide 4, you can see details of the financial performance and progress related to our strategic deliverables. Revenue grew 26% in Q1, with our new products growing nearly $1.8 billion compared with the same period last year.
이번 분기 실적은 2023년에 달성한 강력한 성장세를 이어가고 있음을 보여줍니다. 슬라이드 4에서 재무 성과 및 전략적 결과물과 관련된 진행 상황을 자세히 확인할 수 있습니다. 1분기 매출은 전년 동기 대비 26% 증가했으며, 새로운 제품이 18억 달러 가까이 성장했습니다.

We achieved several key pipeline milestones, including the positive Phase 3 results for tirzepatide in moderate to severe obstructive sleep apnea; the approval of our multi-dose Kwikpen delivery device for Mounjaro in Europe; submission of mirikizumab in the U.S. and in the EU for moderately to severely active Crohn's disease; the resubmission of lebrikizumab in the U.S. for moderate to severe atopic dermatitis; and the initiation of our Phase 3 study for lepodisiran, evaluating efficacy in reducing cardiovascular risk.
중등도에서 중증의 폐쇄성 수면 무호흡증에 대한 티르제파타이드의 긍정적인 임상 3상 결과, 유럽에서 Mounjaro의 다회용 퀵펜 전달 장치 승인, 미국과 유럽에서 미리키주맙의 임상시험 신청 등 여러 주요 파이프라인 마일스톤을 달성했습니다. 미국과 EU에서 중등도에서 중증의 활동성 크론병에 대한 허가 신청, 미국에서 중등도에서 중증의 아토피 피부염에 대한 레브리키주맙의 허가 재신청, 심혈관 위험 감소 효능을 평가하는 레포디시란의 3상 연구 개시 등입니다.
Lilly's top priority is to ensure we execute on our ambitious manufacturing expansion agenda. We recently signed an agreement to acquire an injectable medicine facility from Nexus Pharmaceuticals in Pleasant Prairie, Wisconsin. This state-of-the-art facility has been FDA-approved, and we are targeting to initiate production at the end of 2025. We broke ground earlier this month on our previously-announced parenteral manufacturing site in Germany. And in existing facilities, we are working to maximize output and productivity to meet demand.
릴리의 최우선 과제는 야심찬 제조 확장 계획을 실행하는 것입니다. 최근 위스콘신주 플레전트 프레리에 있는 넥서스 파마슈티컬스(Nexus Pharmaceuticals)로부터 주사제 시설을 인수하는 계약을 체결했습니다. 이 최첨단 시설은 FDA의 승인을 받았으며, 2025년 말부터 생산을 시작하는 것을 목표로 하고 있습니다. 앞서 발표한 독일 비경구 제조 시설은 이달 초에 착공했습니다. 또한 기존 시설에서는 수요를 충족하기 위해 생산량과 생산성을 극대화하기 위해 노력하고 있습니다.
The recent EMA approval and upcoming launch of our multi-dose Kwikpen delivery device for Mounjaro will unlock new supply capacity for Europe and other international markets, while we are also seeing meaningful progress in the ramp of new lines in existing Lilly and CDMO sites for the United States. We continue to make progress against our plans to increase manufacturing capacity, the most ambitious expansion plan in our Company's history.
최근 유럽의약품청(EMA)의 승인과 곧 출시될 Mounjaro용 다회용 퀵펜 전달 장치의 출시로 유럽 및 기타 해외 시장에 새로운 공급 능력을 확보할 수 있게 되었으며, 기존 릴리 및 미국 CDMO 사이트의 신규 라인 증설에서도 의미 있는 진전을 보이고 있습니다. 우리는 회사 역사상 가장 야심찬 확장 계획인 생산 능력 증대 계획에 대한 진전을 계속하고 있습니다.
Lastly, we distributed over $1 billion in dividends during the first quarter. On Slide 5, you'll see a list of the key events since our Q4 earnings call, including the milestones I mentioned earlier and several other important updates.
마지막으로, 1분기에 10억 달러 이상의 배당금을 지급했습니다. 슬라이드 5에서는 앞서 말씀드린 마일스톤과 기타 몇 가지 중요한 업데이트를 포함하여 4분기 실적 발표 이후 주요 이벤트의 목록을 확인할 수 있습니다.

Anat Ashkenazi
Slide 6 summarizes financial performance in the first quarter of 2024. First quarter revenue growth of 26% was driven by new products, primarily Mounjaro and Zepbound. Gross margin as a percent of revenue increased from 78.4% in Q1 2023 to 82.5% in Q1 2024. Gross margin in the quarter benefited from higher realized prices, variable product mix and, to a lesser extent, improved production cost.
슬라이드 6에는 2024년 1분기 재무 성과가 요약되어 있습니다. 26%의 1분기 매출 성장은 주로 Mounjaro와 Zepbound를 비롯한 신제품이 견인했습니다. 매출 총 마진은 2023년 1분기 78.4%에서 2024년 1분기 82.5%로 증가했습니다. 이번 분기의 매출 총이익은 실현 가격 상승, 다양한 제품 믹스, 그리고 생산 비용 개선에 힘입어 증가했습니다.
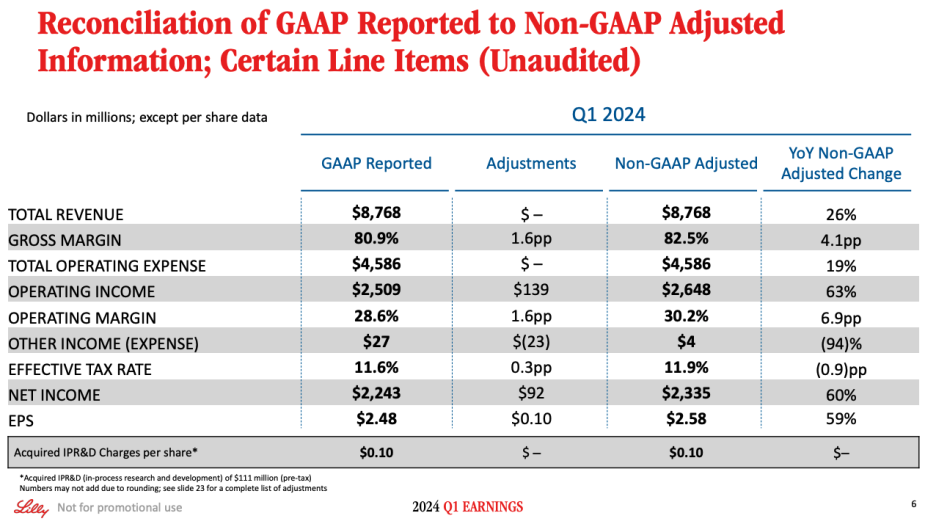
Marketing, selling and administrative expenses increased 12%, primarily driven by promotional efforts supporting current and future launches as well as increased compensation and benefits costs. R&D expenses increased 27%, driven by higher development expenses for late-stage assets and additional investments in early-stage research, as well as a one-time charge of approximately $75 million associated with the termination of the Verzenio prostate program.
마케팅, 판매 및 관리 비용은 현재 및 향후 출시를 지원하는 프로모션 활동과 보상 및 복리후생 비용의 증가로 인해 12% 증가했습니다. R&D 비용은 후기 단계 자산에 대한 개발 비용 증가와 초기 단계 연구에 대한 추가 투자로 인해 27% 증가했으며, 전립선 프로그램 종료와 관련된 약 7,500만 달러의 일회성 비용도 발생했습니다.
In Q1, we recognized the acquired IPR&D charge of $111 million, which negatively impacted EPS by $0.10. Operating income increased 63% in Q1, driven by higher revenue from net -- from new products, partially offset by operating expense growth. Our Q1 effective tax-rate was 11.9% compared to 12.8% in Q1 2023, driven by a larger net discrete tax benefit reflected in Q1 2024 compared with the same period in 2023. We delivered earnings per share of $2.58 in Q1, a 59% increase compared to Q1 2023, inclusive of the negative impact of $0.10 from acquired IPR&D charges in both periods.
1분기에는 인수한 IPR&D 비용 1억 1,100만 달러가 인식되어 주당순이익에 0.10달러의 마이너스 영향을 미쳤습니다. 1분기 영업 이익은 신제품의 매출 증가에 힘입어 63% 증가했으며, 이는 영업 비용 증가로 인해 일부 상쇄되었습니다. 1분기 유효 세율은 11.9%로 2023년 1분기의 12.8%보다 낮아졌는데, 이는 2023년 동기 대비 2024년 1분기에 반영된 순 개별 세금 혜택이 더 커진 데 따른 것입니다. 1분기 주당 순이익은 2.58달러로 2023년 1분기에 비해 59% 증가했으며, 이는 두 기간 동안 인수한 IPR&D 비용으로 인한 0.10달러의 부정적인 영향을 포함할 경우입니다.
On Slide 7, we quantify the effect of price, rate and volume on revenue growth. U.S. revenue increased 28% in Q1, driven by growth of Mounjaro, Zepbound and Verzenio. Unprecedented demand for our incretin medicines led to wholesaler backorders of Trulicity, Mounjaro and Zepbound at quarter-end. Realized prices in the U.S. increased 16%, largely driven by Mounjaro access and savings card dynamics.
슬라이드 7에서는 가격, 요금, 볼륨이 매출 성장에 미치는 영향을 정량화했습니다. 미국 매출은 Mounjaro, Zepbound, Verzenio의 성장에 힘입어 1분기에 28% 증가했습니다. 인크레틴 의약품에 대한 전례 없는 수요로 인해 분기 말에 트루리시티, 모운자로, 제바운드의 도매업체 이월 주문이 발생했습니다. 미국에서의 실현 가격은 16% 증가했으며, 이는 주로 Mounjaro의 접근성과 저축 카드의 역학 관계에 힘입은 것입니다.
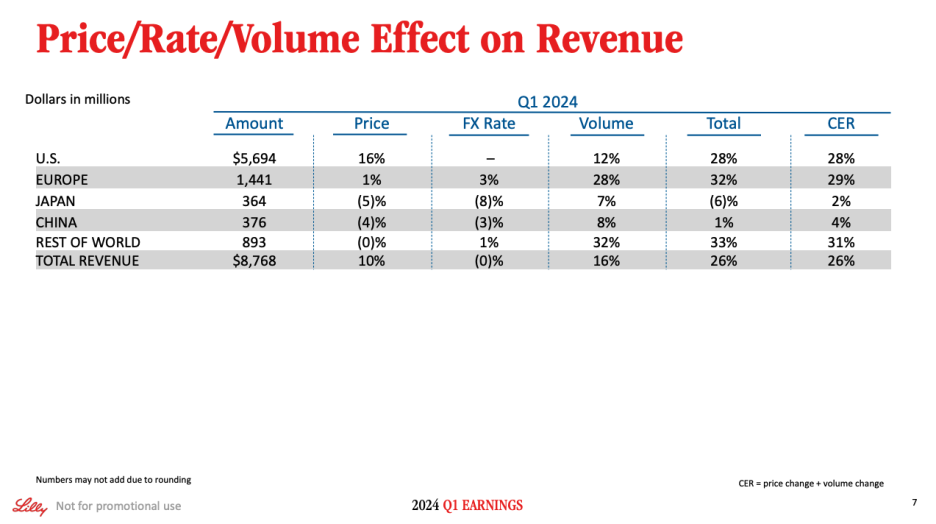
Moving to Europe. Revenue growth was once again strong, increasing 29% in constant currency, driven primarily by volume from Verzenio and Mounjaro as well as payments associated with the distribution and divestiture agreements.
유럽으로 이동. 베르제니오와 마운자로의 매출과 유통 및 매각 계약과 관련된 지불금에 힘입어 다시 한 번 견조한 매출 성장세를 보이며 고정 통화 기준으로 29% 증가했습니다.
Japan revenue grew 2% in constant currency. Volume growth of 7% was driven by Mounjaro and Verzenio, partially offset by decreased volume for Trulicity, and a partnership milestone in the base period. Price declined 5% in the quarter.
일본 매출은 불변 통화 기준으로 2% 성장했습니다. 7%의 볼륨 성장은 Mounjaro와 Verzenio가 주도했으며, Trulicity의 볼륨 감소와 기준 기간의 파트너십 마일스톤으로 인해 부분적으로 상쇄되었습니다. 가격은 분기 중 5% 하락했습니다.
Moving to China. Q1 revenue increased 4% in constant currency. Volume growth was driven by Tyvyt, partially offset by Olumiant and Cialis. Revenue in the rest of the world increased 31% in constant currency, primarily driven by volume growth from Mounjaro and, to a lesser extent, Verzenio and Jardiance.
중국은 1분기 매출은 불변 통화 기준으로 4% 증가했습니다. 타이비트가 볼륨 성장을 주도했으며, 올루미언트와 시알리스가 부분적으로 이를 상쇄했습니다. 나머지 지역에서의 매출은 불변 통화 기준으로 31% 증가했으며, 이는 주로 Mounjaro의 볼륨 성장에 힘입은 것이며, 그 외에는 Verzenio와 Jardiance의 성장에 힘입은 바가 컸습니다.
Slide 8 provides additional perspective across our product categories. First, I would like to highlight Verzenio, which saw worldwide sale increase 40% in Q1, driven by continued volume growth in the early breast cancer indication. Jaypirca revenue increased to $50 million worldwide, representing an acceleration in sequential quarterly growth, following the December 2023 approval for the CLL indication. We're looking forward to potentially making this medicine available to even more patients as future Phase 3 trials read-out.
슬라이드 8은 제품 카테고리 전반에 걸친 추가적인 관점을 제공합니다. 먼저, 초기 유방암 적응증에서 지속적인 볼륨 성장에 힘입어 1분기에 전 세계 매출이 40% 증가한 버제니오에 대해 말씀드리겠습니다. 제이피르카의 매출은 전 세계적으로 5천만 달러로 증가하여 2023년 12월 CLL 적응증에 대한 승인 이후 분기별 성장세가 가속화되고 있음을 보여주었습니다. 향후 3상 임상시험 결과가 나오면 더 많은 환자에게 이 약을 제공할 수 있을 것으로 기대하고 있습니다.
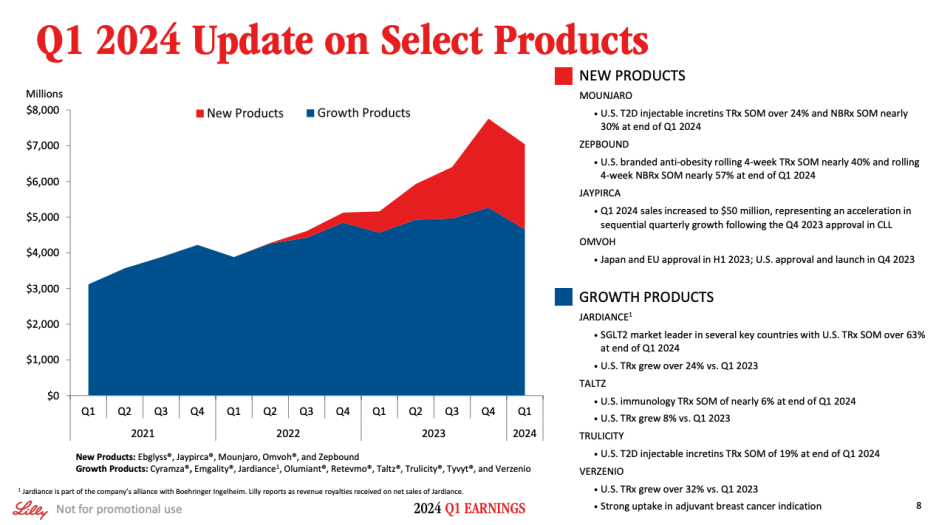
Next, in Q1, Mounjaro sales were $1.8 billion globally and $1.5 billion in the U.S., up from $568 million and $536 million in Q1 2023, respectively. Sequential quarter-over-quarter revenue for Mounjaro in the U.S. was impacted by a one-time benefit from changes in estimates for rebates and discounts in Q4 2023, as well as lower inventory in the channel in Q4 2024 amid strong demand. Access level across commercial and Part D were consistent with high levels we communicated on our last earnings call, and near parity with established injectable incretin medicines.
다음으로, 1분기 Mounjaro의 매출은 전 세계적으로 18억 달러, 미국에서 15억 달러로 2023년 1분기의 각각 5억 6,800만 달러와 5억 3,600만 달러에서 증가했습니다. 미국에서의 전분기 대비 매출은 2023년 4분기 리베이트 및 할인 추정치 변경에 따른 일회성 이익과 2024년 4분기 수요 강세에 따른 채널 내 재고 감소의 영향을 받았습니다. 상업용 및 파트 D의 접근성 수준은 지난 실적 발표에서 밝힌 높은 수준과 일치했으며, 기존 주사제 인크레틴 의약품과 거의 비슷한 수준이었습니다.
The demand for tirzepatide is very strong, and each week hundreds of thousands of people fill scripts for Mounjaro and Zepbound. Yet, we understand the frustration from those facing prescription delays or uncertainties getting their medicine. While we are working tirelessly to ramp supply and expect meaningful increases in shipment volumes in the second half of the year, demand continues to outstrip even increased supply. We remain on-track to meet expectations we set earlier this year. The production of saleable doses of incretin medicine in the second half of 2024 will be at least 1.5 times the saleable doses in the second half of 2023. In the short- to mid-term, we expect sales growth to primarily be a function of the quantities we can produce and ship.
티르제파타이드에 대한 수요는 매우 높으며 매주 수십만 명의 사람들이 마운자로와 젭바운드에 대한 처방전을 작성하고 있습니다. 하지만 처방 지연이나 불확실한 약품 수급에 직면한 환자들의 불만을 잘 알고 있습니다. 공급량을 늘리기 위해 부단히 노력하고 있으며 하반기에는 배송량이 의미 있게 증가할 것으로 예상하고 있지만, 수요가 공급량 증가를 계속 앞지르고 있습니다. 올해 초에 설정한 기대치를 충족하기 위해 순조롭게 진행 중입니다. 2024년 하반기에 판매 가능한 인크레틴 의약품 생산량은 2023년 하반기 판매 가능 용량의 1.5배 이상이 될 것입니다. 단기 및 중기적으로 매출 성장은 주로 생산 및 출하할 수 있는 수량에 따라 좌우될 것으로 예상합니다.
Outside the U.S., we're delighted that the multi-dose Kwikpen delivery device from Mounjaro was recently approved in the EU, adding to the U.K. approval earlier this year. This approval applies to both the Type 2 diabetes and chronic weight management indication, as they are under the single-brand in Europe. While timing for launch will vary by country, we expect to start launching in the EU in coming weeks.
미국 외 지역에서는 올해 초 영국 승인에 이어 최근 EU에서 Mounjaro의 다회용 퀵펜 전달 장치가 승인된 것을 기쁘게 생각합니다. 이번 승인은 유럽에서 단일 브랜드로 판매되는 2형 당뇨병과 만성 체중 관리 적응증 모두에 적용됩니다. 출시 시기는 국가별로 다르지만, 몇 주 내에 EU에서 출시될 것으로 예상됩니다.
In Q1, worldwide Trulicity revenue declined 26%. U.S. Trulicity revenue decreased 30%, driven by lower volume, primarily due to supply constraints and competitive dynamics. In addition, sales in international markets were impacted by measures we have taken to minimize disruption to existing patients, including communicating to healthcare professionals to not start new patients on Trulicity.
1분기 전 세계 트루리시티 매출은 26% 감소했습니다. 미국 트루리시티 매출은 주로 공급 제약과 경쟁 심화로 인한 물량 감소로 인해 30% 감소했습니다. 또한, 해외 시장에서의 매출은 기존 환자들의 혼란을 최소화하기 위해 의료 전문가들에게 트루리시티로 신규 환자 치료를 시작하지 말 것을 알리는 등 취한 조치로 인해 영향을 받았습니다.
Turning to Slide 9. We have seen exceptionally strong U.S. launch progress for Zepbound, with over $0.5 billion in sales in Q1. We're rapidly building out access for Zepbound in the U.S. And as of April 1, we have approximately 67% access in the commercial segment. As a reminder, patients' access in this market is a two-step process, typically require individual employers to opt-in to an anti-obesity medicine rider, following PBM coverage. We are continuing to focus on broadening access, both with PBMs and through employer opt-ins. And early progress is encouraging.
슬라이드 9로 넘어가겠습니다. 1분기에 0.5억 달러 이상의 매출을 달성하는 등 Zepbound의 미국 출시가 매우 순조롭게 진행되고 있습니다. 미국에서 Zepbound에 대한 접근성을 빠르게 구축하고 있으며, 4월 1일 현재 상업용 부문에서 약 67%의 접근성을 확보하고 있습니다. 다시 한 번 말씀드리지만, 이 시장에서 환자들의 접근은 2단계 절차로 이루어지며, 일반적으로 개별 고용주가 PBM 보험 적용에 이어 비만 치료제 라이더에 옵트인해야 합니다. 우리는 PBM과 고용주 옵트인을 통해 접근성을 확대하는 데 계속 집중하고 있습니다. 그리고 초기 진전은 고무적입니다.

On Slide 10, we provide an update on capital allocation. Slide 11 shows updated 2024 financial guidance. Given the strength we're seeing in our business and projections for continued acceleration expected in the second-half of the year, we're increasing our full-year revenue outlook by $2 billion on the top- and bottom-end of the range to be between $42.4 billion to $43.6 billion. This increase is primarily due to the strong performance of Mounjaro and Zepbound, and greater visibility and confidence into our production expansion for the remainder of 2024. With this update, year-over-year revenue growth for the Company is now expected to be approximately 26% at the midpoint or approximately 35% for the core business, which excludes the impact from global divestitures.
슬라이드 10에서는 자본 배분에 대한 업데이트를 제공합니다. 슬라이드 11에서는 업데이트된 2024년 재무 가이던스를 보여드리겠습니다. 비즈니스의 강세와 하반기에 예상되는 지속적인 가속화를 감안하여 연간 매출 전망치를 상한선과 하한선에서 20억 달러씩 상향 조정하여 424억 달러에서 436억 달러 사이로 상향 조정합니다. 이러한 증가는 주로 Mounjaro와 Zepbound의 강력한 실적과 2024년 남은 기간 동안의 생산 확장에 대한 가시성과 자신감이 높아졌기 때문입니다. 이번 업데이트를 통해 회사의 전년 대비 매출 성장률은 중간 시점에서 약 26%, 글로벌 매각으로 인한 영향을 제외한 핵심 비즈니스의 경우 약 35%가 될 것으로 예상됩니다.
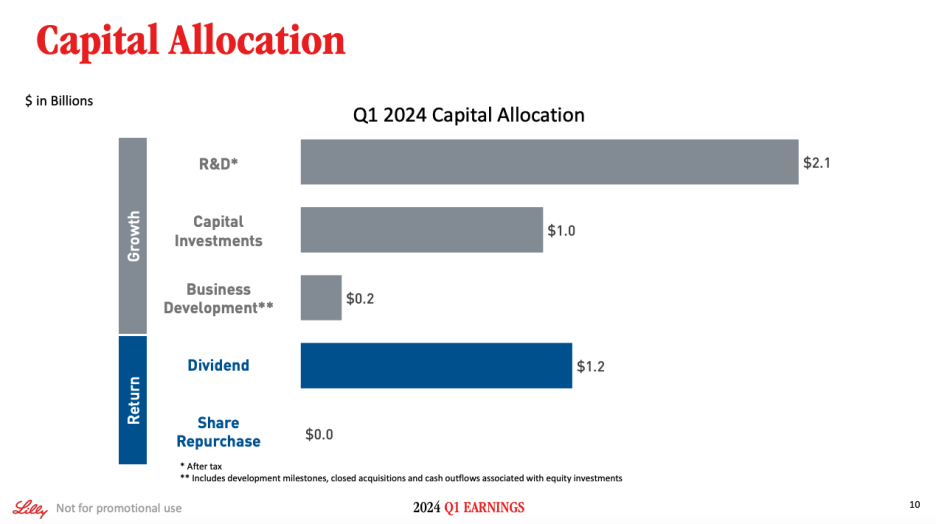
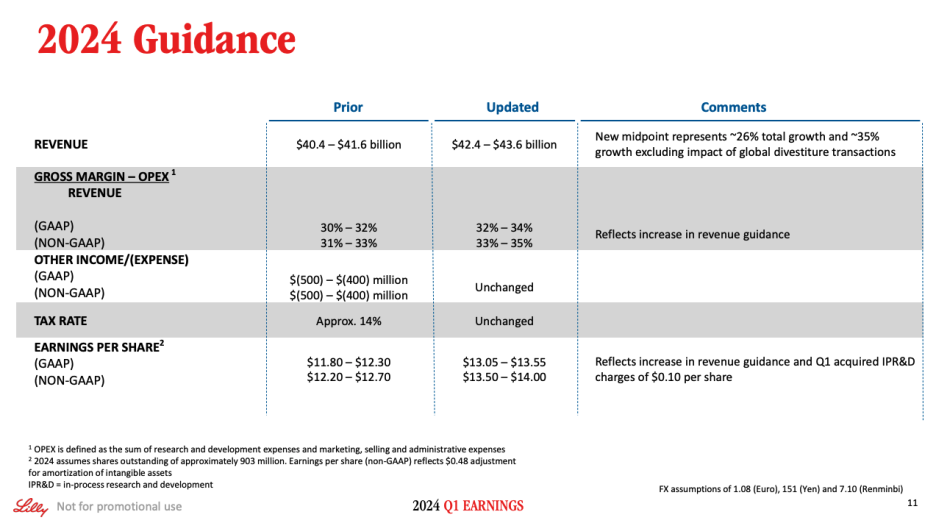
Given the update to revenue guidance, we now expect the ratio of gross margin less opex divided by revenue to be in the range of 32% to 34% on a reported basis and 33% to 35% on a non-GAAP basis, representing further margin expansion. We are reaffirming guidance for other income and expense and tax rate, which now takes into consideration Q1 results. Based on these updates and inclusive of Q1 IPR&D charges of $0.10 per share, we now expect EPS to be in the range of $13.05 to $13.55 on a reported basis and $13.50 to $14.00 on a non-GAAP basis.
수익 가이던스 업데이트에 따라 이제 매출총이익에서 영업비용을 뺀 비율을 매출로 나눈 비율은 보고 기준으로는 32%에서 34%, 비일반회계기준으로는 33%에서 35% 범위가 될 것으로 예상되며, 이는 추가적인 마진 확대를 의미합니다. 기타 수익 및 비용과 세율에 대한 가이던스를 재확인하며, 이는 1분기 실적을 고려한 것입니다. 이러한 업데이트와 1분기 주당 0.10달러의 IPR&D 비용을 포함하여 이제 보고 기준 주당순이익은 13.05~13.55달러, 비일반회계기준 주당순이익은 13.50~14.00달러 범위가 될 것으로 예상합니다.
Daniel M. Skovronsky
Let me start with our exciting announcement from earlier this month. That was the positive Phase 3 results from the SURMOUNT-OSA studies, which evaluated tirzepatide for treatment of adults with obesity and moderate to severe obstructive sleep apnea, known as OSA. OSA is a sleep-related breathing disorder characterized by complete or partial collapse of the upper airway during sleep. OSA can have serious cardiometabolic complications, contributing to hypertension, coronary heart disease, stroke, heart failure, atrial fibrillation and even Type 2 diabetes. The need is significant. OSA impacts 80 million people in the U.S., with more than 20 million people suffering from moderate to severe OSA. We also know that a substantial majority, approximately 70%, of people with OSA also live with obesity.
이달 초에 발표한 흥미로운 소식부터 말씀드리겠습니다. 바로 성인 비만 및 중등도에서 중증의 폐쇄성 수면무호흡증(OSA) 환자를 대상으로 티르제파타이드를 평가한 SURMOUNT-OSA 임상 3상 연구의 긍정적인 결과입니다. OSA는 수면 중 상기도가 완전히 또는 부분적으로 무너지는 것을 특징으로 하는 수면 관련 호흡 장애입니다. OSA는 고혈압, 관상동맥 심장 질환, 뇌졸중, 심부전, 심방세동, 심지어 제2형 당뇨병을 유발하는 심각한 심장대사 합병증을 유발할 수 있습니다. 그 필요성은 매우 큽니다. 미국에서는 8천만 명이 OSA를 앓고 있으며, 2천만 명 이상이 중등도에서 중증의 OSA를 앓고 있습니다. 또한 OSA 환자의 상당수(약 70%)가 비만을 동반하고 있다는 사실도 잘 알려져 있습니다.
While there are pharmaceutical treatments for the excessive day-time sleepiness associated with OSA, tirzepatide could potentially be the first pharmacological treatment for the underlying disease.
OSA와 관련된 과도한 주간 졸림증에 대한 약물 치료법이 있지만, 티르제파타이드는 잠재적으로 기저 질환에 대한 최초의 약물 치료법이 될 수 있습니다.
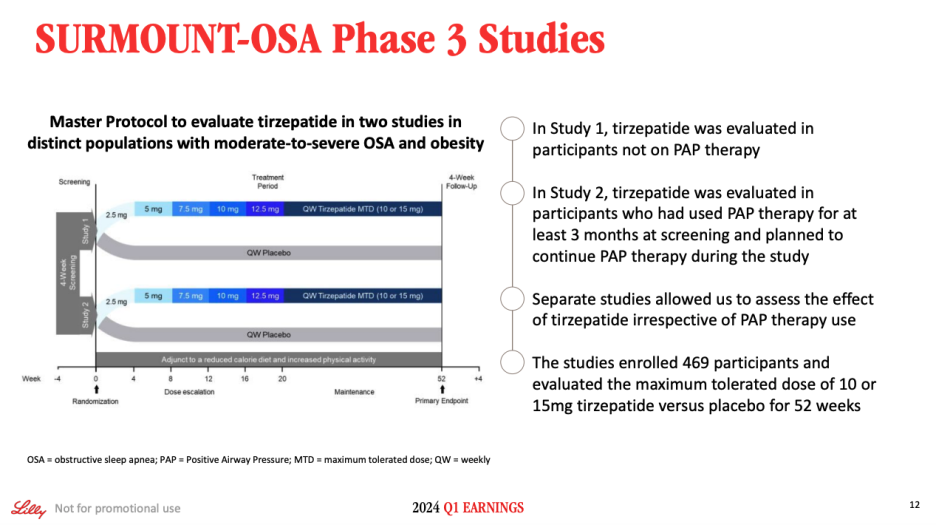
As shown on Slide 12, SURMOUNT-OSA was comprised of two separate trials run under one master protocol. Study 1 evaluated tirzepatide in participants not currently on positive airway pressure, or PAP, therapy. While Study 2 evaluated tirzepatide in patients who had used PAP for at least three months prior to the study and planned to continue PAP therapy during the entire course of the trial. The total of 469 participants were enrolled across these studies. Each study randomized participants to either maximum tolerated dose approved for tirzepatide, which could be 10 milligrams or 15 milligrams or to placebo, and patients were followed on therapy for 52 weeks.
슬라이드 12에서 볼 수 있듯이 SURMOUNT-OSA는 하나의 마스터 프로토콜에 따라 실행된 두 개의 개별 임상시험으로 구성되었습니다. 임상 1에서는 현재 양압기 치료(PAP)를 받고 있지 않은 참가자를 대상으로 티르제파타이드를 평가했습니다. 임상 2는 임상시험 전 최소 3개월 동안 양압기 치료를 받은 적이 있고 전체 임상시험 기간 동안 양압기 치료를 계속할 계획인 환자를 대상으로 티르제파타이드를 평가했습니다. 이 연구에는 총 469명의 참가자가 등록했습니다. 각 연구에서는 참가자를 무작위로 티르제파타이드에 대해 승인된 최대 내약 용량(10밀리그램 또는 15밀리그램) 또는 위약으로 배정하고 52주 동안 치료를 추적 관찰했습니다.
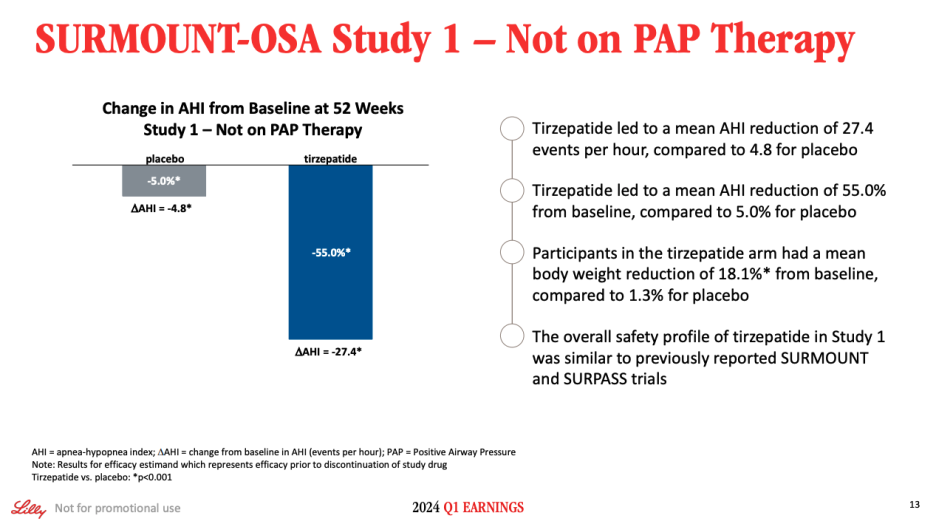
On Slide 13, we show the results of Study 1. For the efficacy estimate, on mean Apnea Hypopnea Index, or AHI, tirzepatide led to a mean reduction of 27.4 events per hour compared to a mean AHI reduction of 4.8 events per hour for placebo. This difference was highly statistically significant. AHI baseline values were 52.9% and AHI was reduced by 55% in the tirzepatide arm. We also saw a mean body weight reduction of 18.1% with tirzepatide treatment, consistent with our expectations for the study. This was, of course, also statistically significant versus placebo.
슬라이드 13에는 연구 1의 결과가 나와 있습니다. 효능 추정치의 경우, 평균 무호흡 저호흡 지수(AHI)에서 티르제파타이드는 시간당 평균 27.4건의 사건을 감소시킨 반면, 위약은 시간당 평균 4.8건의 사건을 감소시켰습니다. 이 차이는 통계적으로 매우 유의미했습니다. 티르제파타이드 투여군의 기준치는 52.9%였고, 티르제파타이드 투여군은 55% 감소했습니다. 또한 티르제파타이드 치료로 평균 18.1%의 체중 감소를 보였으며, 이는 연구에 대한 기대와 일치했습니다. 물론 이 역시 위약과 비교했을 때 통계적으로 유의미한 결과였습니다.
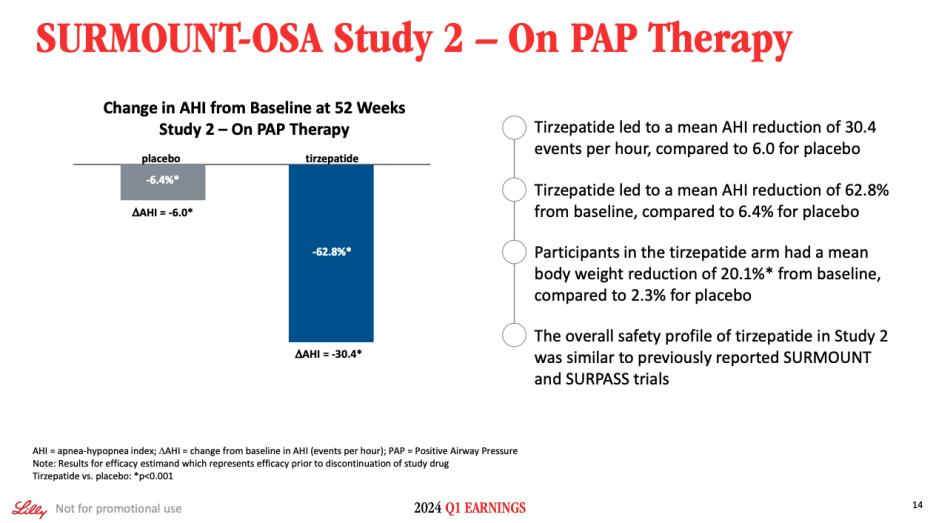
On Slide 14, we show the results of Study 2. In this population, for the efficacy estimate, tirzepatide led to a mean AHI reduction of 30.4 events per hour compared to a mean AHI reduction of 6.0 events per hour for placebo. The baseline AHI was 46.1% in the tirzepatide arm, and mean AHI reduction was 62.8%. Again, we saw impressive weight loss with a mean body rate reduction of 20.1% from baseline. These results were also all highly statistically significant.
슬라이드 14에는 연구 2의 결과가 나와 있습니다. 이 집단에서 유효성 추정 결과, 티르제파타이드는 시간당 평균 30.4건의 AHI를 감소시킨 반면, 위약은 시간당 평균 6.0건의 AHI를 감소시켰습니다. 티르제파타이드 투여군의 베이스라인 AHI는 46.1%였고, 평균 AHI 감소율은 62.8%였습니다. 또한, 평균 체질량지수가 베이스라인 대비 20.1% 감소하여 인상적인 체중 감소를 보였습니다. 이러한 결과는 모두 통계적으로도 매우 유의미했습니다.
In both studies, the overall safety profile was similar to previously reported SURMOUNT and SURPASS trials. The most commonly reported adverse events were gastrointestinal related and generally mild to moderate in severity, with the most commonly reported gastrointestinal adverse events for patients treated with tirzepatide being diarrhea, nausea, vomiting and constipation.
두 연구 모두에서 전반적인 안전성 프로파일은 이전에 보고된 SURMOUNT 및 SURPASS 임상시험과 유사했습니다. 가장 흔하게 보고된 부작용은 위장 관련 부작용이었으며 일반적으로 경증에서 중등도의 중증도였으며, 티르제파타이드로 치료받은 환자에서 가장 흔하게 보고된 위장 부작용은 설사, 메스꺼움, 구토 및 변비였습니다.
Prior to the study read-out, we noted investor questions about what level of weight loss we would see, given several factors that were uniquely combined in this study of tirzepatide. First, the primary aim of the study was not treatment of obesity. Second, that the population was approximately 70% males, in whom, weight loss can be harder to achieve with incretin medicines. Third, there was a particularly high baseline BMI in this population. And finally, the use of the 10-milligram or 15-milligram maximum tolerated dose approach. We were, therefore, highly reassured to see weight loss observed across the two studies at 52 weeks was nearly 20% despite this difficult-to-treat population. Consistent with other Phase 3 studies of tirzepatide at the 52-week time point, we did not see weight loss plateau. We'll present detailed results of SURMOUNT-OSA during a symposium at ADA on June 21st. Additionally, we plan to submit to the FDA and other global regulatory agencies beginning mid-year.
연구 결과를 발표하기 전에 티르제파타이드에 대한 이 연구에서 독특하게 결합된 몇 가지 요인을 고려할 때 어느 정도의 체중 감소를 볼 수 있을지에 대한 투자자들의 질문에 주목했습니다. 첫째, 연구의 주된 목적이 비만 치료가 아니었다는 점입니다. 둘째, 인크레틴 의약품으로 체중 감량이 더 어려울 수 있는 남성이 약 70%에 달한다는 점입니다. 셋째, 이 그룹의 기초 체질량 지수가 특히 높았다는 점입니다. 마지막으로, 10밀리그램 또는 15밀리그램의 최대 내약 용량을 사용했습니다. 따라서 치료가 어려운 집단임에도 불구하고 두 연구에서 52주째에 20%에 가까운 체중 감소가 관찰되어 매우 안심할 수 있었습니다. 52주 시점에서 티르제파티드의 다른 3상 임상시험과 마찬가지로 체중 감소가 정체되는 현상도 관찰되지 않았습니다. 6월 21일에 열리는 미국당뇨병학회 심포지엄에서 SURMOUNT-OSA의 자세한 결과를 발표할 예정입니다. 또한 올해 중반부터 FDA 및 기타 글로벌 규제 기관에 제출할 계획입니다.
Moving to the other updates across our portfolio. Slide 15 shows select pipeline opportunities as of April 26, and slide 16 shows potential key events for the year. We're pleased to share that results were positive in QWINT-4, the first Phase 3 study of insulin efsitora alfa, our once-weekly basal insulin. This study evaluated efsitora compared to insulin glargine in adult participants with Type 2 diabetes who are on multiple daily insulin injections. In the coming weeks, we expect to report top-line results from QWINT-4 as well as QWINT-2, which is evaluating efsitora compared to degludec in adults with Type 2 diabetes who are naive to basal insulin. Together, these are the first two of five studies in the efsitora Phase 3 program.
포트폴리오 전반의 다른 업데이트로 이동합니다. 슬라이드 15는 4월 26일 현재 일부 파이프라인 기회를 보여주고, 슬라이드 16은 올해 잠재적인 주요 이벤트를 보여줍니다. 주 1회 기저 인슐린인 인슐린 에프시토라 알파의 첫 번째 3상 연구인 QWINT-4의 결과가 긍정적이었음을 공유하게 되어 기쁘게 생각합니다. 이 연구는 매일 여러 번 인슐린 주사를 맞고 있는 성인 제2형 당뇨병 환자를 대상으로 인슐린 글라진과 비교하여 에프시토라를 평가했습니다. 향후 몇 주 내에 기저 인슐린에 반응하지 않는 성인 제2형 당뇨병 환자를 대상으로 에프시토라와 데글루덱을 비교 평가한 QWINT-4와 QWINT-2의 탑라인 결과도 발표할 예정입니다. 이 두 연구는 에프시토라 임상 3상 프로그램의 5개 연구 중 첫 번째 두 연구입니다.
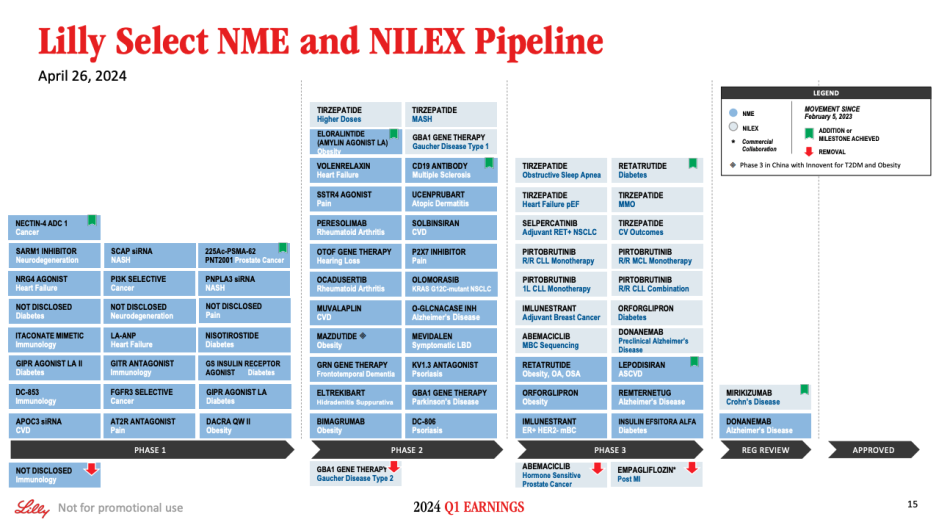

Additional updates in our late-stage diabetes and obesity pipeline include results of the EMPACT-MI study, showing Jardiance had a 10% relative risk reduction in the primary composite endpoint of time-to-first hospitalization due to heart failure or all-cause mortality versus placebo, which did not reach statistical significance. We've completed enrollment for SURMOUNT-MMO with over 15,000 participants and for both orforglipron studies in chronic weight management, ATTAIN-1 and ATTAIN-2, which together enrolled 4,500 participants. Finally, we've now initiated the TRANSCEND Phase 3 program, studying retatrutide in Type 2 diabetes.
후기 단계 당뇨병 및 비만 파이프라인에 대한 추가 업데이트에는 EMPACT-MI 연구 결과가 포함되며, 이 연구에서 자디앙은 위약 대비 심부전 또는 모든 원인으로 인한 첫 번째 입원까지의 시간이라는 1차 복합 평가변수에서 통계적 유의성에 도달하지 않은 10%의 상대 위험 감소 효과를 나타냈습니다. 우리는 15,000명 이상의 참가자가 참여한 SURMOUNT-MMO와 4,500명이 참여한 만성 체중 관리를 위한 두 가지 오르글리프론 연구인 ATTAIN-1 및 ATTAIN-2에 대한 등록을 마쳤으며, 총 4,500명의 참가자가 등록을 완료했습니다. 마지막으로, 현재 제2형 당뇨병 환자를 대상으로 레타트루타이드를 연구하는 TRANSCEND 3상 프로그램을 시작했습니다.
In the cardiovascular disease area, we're excited to have initiated the Phase 3 trial for lepodisiran, the subcutaneous injectable SiRNA. This study will evaluate the efficacy and improving cardiovascular outcomes for participants with high lipoprotein(a) who have cardiovascular disease, or at a risk of heart attack or stroke. We are evaluating the efficacy of lepodisiran in both secondary and high-risk primary prevention. And we hope this will one day offer healthcare providers a treatment option for a broad group of patients at increased cardiovascular risk due to high LPA levels. Earlier in our diabetes and obesity pipeline, we've now initiated a Phase 2 monotherapy study, evaluating eloralintide, our selective amylin receptor agonist in obesity.
심혈관 질환 분야에서 피하 주사형 SiRNA인 레포디시란에 대한 3상 임상시험을 시작하게 되어 매우 기쁩니다. 이 연구는 심혈관 질환이 있거나 심장마비 또는 뇌졸중 위험이 있는 고지단백(a) 환자를 대상으로 효능과 심혈관 질환 개선 효과를 평가할 것입니다. 저희는 레포디시란의 2차 예방과 고위험군 1차 예방 모두에 대한 효능을 평가하고 있습니다. 언젠가 의료진에게 높은 LPA 수치로 인해 심혈관 질환 위험이 높은 광범위한 환자 그룹에 대한 치료 옵션을 제공할 수 있기를 바랍니다. 당뇨병 및 비만 파이프라인의 초기 단계에서는 선택적 아밀린 수용체 작용제인 엘로랄린타이드를 평가하는 2상 단독요법 연구에 착수했습니다.
Turning to oncology, we made the decision to terminate for futility the Phase 3 CYCLONE-3 trial, evaluating Verzenio in metastatic hormone-sensitive prostate cancer following an interim analysis. This concludes development of Verzenio in prostate cancer following last quarter's announcement that the CYCLONE-2 study did not meet its primary endpoint. In early oncology development, we've initiated Phase 1 trials for two new assets. The first is our Nectin-4 ADC, which came from our acquisition of Emergence Therapeutics. The second is PNT2001, which came from our acquisition of Point Biopharma. We're encouraged by what we're seeing in our oncology portfolio and expect 2024 to be particularly productive.
종양학 분야로 눈을 돌려 중간 분석 결과 전이성 호르몬 민감성 전립선암 환자를 대상으로 버제니오를 평가하는 임상 3상 CYCLONE-3 시험의 무용성을 이유로 종료하기로 결정했습니다. 이로써 전립선암에 대한 버제니오의 개발은 지난 분기 CYCLONE-2 임상시험이 1차 평가변수를 충족하지 못했다는 발표에 따라 마무리되었습니다. 초기 항암제 개발 단계에서 우리는 두 가지 새로운 자산에 대한 1상 임상시험을 시작했습니다. 첫 번째는 이머전스 테라퓨틱스 인수를 통해 확보한 넥틴-4 ADC입니다. 두 번째는 포인트 바이오파마 인수를 통해 얻은 PNT2001입니다. 저희는 종양학 포트폴리오의 성과에 고무되어 있으며 2024년이 특히 생산적인 해가 될 것으로 기대하고 있습니다.
Along with the Nectin-4 ADC and PNT2001 start, we expect at least three other new molecules to enter the clinic this year. We look forward to sharing more details with the investment community at an oncology-focused investor event hosted by the Lilly Oncology team. This event will take place on the evening of Sunday, June 2 in Chicago, in conjunction with the ASCO Annual Meeting, and will also be available via webcast. We plan to provide an update on our oncology strategy and pipeline opportunities. Additional details will be available soon regarding this event.
Nectin-4 ADC 및 PNT2001과 함께 올해 최소 3개의 새로운 분자가 임상에 진입할 것으로 예상하고 있습니다. 릴리 종양학 팀이 주최하는 종양학 중심 투자자 행사에서 투자 커뮤니티와 더 자세한 내용을 공유할 수 있기를 기대합니다. 이 행사는 6월 2일(일) 저녁 시카고에서 ASCO 연례 회의와 함께 열리며 웹캐스트를 통해서도 시청할 수 있습니다. 이 행사에서는 종양학 전략과 파이프라인 기회에 대한 업데이트가 제공될 예정입니다. 이 행사에 대한 자세한 내용은 곧 공개될 예정입니다.
Turning to neuroscience. Last month, we announced that the FDA plans to convene a meeting of the Peripheral and CNS Drugs Advisory Committee to discuss donanemab in early symptomatic Alzheimer's disease. We expect the Advisory Committee meeting will take place in mid-2024, but the exact date will be confirmed when it appears in the federal register. We expect the focus to be around the safety and efficacy profile of donanemab, along with unique aspects of the clinical program. We remain confident in donanemab's potential to offer very meaningful benefits to patients and look forward to addressing the FDA's questions in this form. Additionally, we made the decision to discontinue investigation of GBA1, our gene therapy asset in Gaucher disease Type 2. Phase 2 studies in Parkinson's disease and Gaucher disease Type 1 are still underway and have not been impacted by this decision.
신경과학으로 눈을 돌리다. 지난달, 저희는 FDA가 초기 증상 알츠하이머병에 대한 도나넴맙에 대해 논의하기 위해 말초 및 중추신경계 약물 자문위원회 회의를 소집할 계획이라고 발표했습니다. 자문위원회 회의는 2024년 중반에 열릴 것으로 예상되지만 정확한 날짜는 연방 관보에 게재되면 확정될 예정입니다. 도나넴맙의 안전성 및 효능 프로필과 임상 프로그램의 고유한 측면에 초점을 맞출 것으로 예상합니다. 우리는 도나넴맙이 환자들에게 매우 의미 있는 혜택을 제공할 수 있는 잠재력을 여전히 확신하고 있으며, 이 자료를 통해 FDA의 의문을 해소할 수 있기를 기대합니다. 또한, 우리는 고셔병 2형에 대한 유전자 치료 자산인 GBA1에 대한 연구를 중단하기로 결정했습니다. 파킨슨병과 고셔병 1형에 대한 2상 연구는 여전히 진행 중이며 이번 결정에 영향을 받지 않았습니다.
Finally, in immunology, we submitted mirikizumab to the FDA and EMA for approval for use in adults with moderately to severely active Crohn's disease. In the U.S., we've resubmitted lebrikizumab's application to the FDA for moderate to severe atopic dermatitis. This is following a Complete Response Letter based on inspection findings at a third-party manufacturer. As a reminder, the letter stated no concerns with the clinical data package, safety or label. We expect regulatory action in the second-half of this year.
마지막으로 면역학 분야에서는 중등도에서 중증 활동성 크론병 성인 환자에 대한 사용 승인을 위해 FDA와 EMA에 미리키주맙을 제출했습니다. 미국에서는 중등도에서 중증의 아토피 피부염에 대한 레브리키주맙의 허가 신청서를 FDA에 다시 제출했습니다. 이는 타사 제조업체의 검사 결과를 바탕으로 한 전체 답변서에 따른 것입니다. 이 서한에는 임상 데이터 패키지, 안전성 또는 라벨에 대한 우려 사항은 없다고 명시되어 있습니다. 올해 하반기에 규제 당국의 조치가 있을 것으로 예상됩니다.
We're also announcing that in the coming months, we'll be initiating Phase 3 studies evaluating lebrikizumab in two new indications, chronic rhinitis with nasal polyposis and allergic rhinitis due to perennial allergens. Lebrikizumab will be the first biologic to be evaluated in Phase 3 for allergic rhinitis. We're optimistic about the potential of lebrikizumab to be an important treatment option in these patient populations as well as in atopic dermatitis. In earlier-stage immunology development, we advanced our CD19 antibody into Phase 2 for multiple sclerosis.
또한 앞으로 몇 달 안에 코 폴립증을 동반한 만성 비염과 다년생 알레르겐으로 인한 알레르기 비염이라는 두 가지 새로운 적응증에 대해 레브리키주맙을 평가하는 3상 임상시험을 시작할 예정이라고 발표했습니다. 레브리키주맙은 알레르기 비염에 대한 3상 임상시험에서 평가되는 최초의 생물학적 제제가 될 것입니다. 우리는 레브리키주맙이 아토피 피부염뿐만 아니라 이러한 환자 집단에서 중요한 치료 옵션이 될 수 있는 잠재력에 대해 낙관하고 있습니다. 초기 단계의 면역학 개발에서 우리는 다발성 경화증에 대한 CD19 항체를 2상까지 진행했습니다.
David A. Ricks
Before we go to Q&A, let me briefly sum-up the progress in our first quarter. Strong revenue growth in Q1 was driven by our recent product launches, primarily Mounjaro and Zepbound. We expect acceleration in revenue growth through the second half of the year, as supply of incretin medicines continues to ramp. Significant advances in our pipeline include top-line data from tirzepatide in SURMOUNT-OSA, approval of the Kwikpen delivery device for Mounjaro in the EU, submission of mirikizumab and lebrikizumab as well as initiation of lepodisiran, sorry, Phase 3 study as Dan just mentioned.
Q&A에 들어가기 전에 1분기 실적을 간략히 요약해 보겠습니다. 1분기의 강력한 매출 성장은 최근 출시한 제품, 특히 Mounjaro와 Zepbound가 견인했습니다. 인크레틴 의약품의 공급이 계속 증가함에 따라 하반기까지 매출 성장이 가속화될 것으로 예상합니다. 우리 파이프라인의 중요한 진전으로는 서마운트-OSA의 티르제파타이드 탑라인 데이터, 문자로의 퀵펜 전달 장치 EU 승인, 미리키주맙과 레브리키주맙의 제출, 방금 댄이 언급한 레포디시란의 3상 연구 개시가 있습니다.
We are continuing to invest in recent and upcoming launches, internal and external pipeline development and our manufacturing expansion agenda. This is to sustain our long-term growth outlook.
최근 및 향후 출시 예정 제품, 내부 및 외부 파이프라인 개발, 제조 확장 아젠다에 지속적으로 투자하고 있습니다. 이는 장기적인 성장 전망을 유지하기 위한 것입니다.
Questions and Answers:
Chris Schott— J.P. Morgan
Great. Thanks so much and congrats on all the progress here. I just had a question. Just was hoping you could elaborate a bit more on the capacity dynamics that are leading to the guidance raised today. I specifically just looking for a little more color of is this more U.S. or international? And should we read this as more capacity in the system than you expected, or just a faster ramp of the new plant and maybe the same overall capacity as you exit the year? Thanks so much.
잘됐네요. 정말 감사드리며 모든 진전을 축하합니다. 질문이 하나 있는데요. 오늘 제기된 지침으로 이어지는 용량에 대해 좀 더 자세히 설명해 주셨으면 좋겠습니다. 특히 이것이 미국에만 국한된 것인지 아니면 국제적인 것인지에 대해 좀 더 자세히 알고 싶습니다. 그리고 예상보다 시스템 용량이 더 늘어난 것으로 읽어야 할까요, 아니면 새 공장이 더 빨리 가동되고 연말에 전체 용량이 동일할 수도 있다는 의미로 읽어야 할까요? 감사합니다.
Anat Ashkenazi— Executive Vice President and Chief Financial Officer
Thanks for the question, Chris. And as we've mentioned earlier in the year when we issued guidance, we said that we expect capacity and supply to ramp towards the second-half of the year, and that's what we're seeing. Now, as a reminder, we do have quite a large number of nodes across our supply chain that have to come online or ramp capacity. We are -- if you look at everything work -- we have under-construction or ramping-up, we have six sites right now between the two sites in North Carolina, a site in Ireland, two sites in Indiana, a site in Germany and then a seventh one that we just purchased. They're all either ramping-up or under-construction.
질문 감사합니다, Chris. 올해 초에 가이던스를 발표할 때 언급했듯이 하반기로 갈수록 용량과 공급이 증가할 것으로 예상한다고 말씀드렸고, 실제로 그렇게 되고 있습니다. 다시 한 번 말씀드리지만, 공급망 전반에 걸쳐 온라인 상태가 되거나 용량을 늘려야 하는 노드가 상당히 많이 있습니다. 현재 노스캐롤라이나의 두 사이트, 아일랜드의 한 사이트, 인디애나의 두 사이트, 독일의 한 사이트, 그리고 방금 매입한 일곱 번째 사이트까지 총 여섯 개의 사이트가 건설 중이거나 증설 중에 있습니다. 모두 확장 중이거나 건설 중입니다.
And there are multiple nodes across that supply chain that have to become operational, which requires approval, etc. for three products, depend on which product runs on which line, that are planned throughout the year. Now that we're four months into the year, we have greater visibility into that -- into these nodes of capacity and feel more confident. Just as one example, the approval of the Kwikpen in Europe that just came in slightly ahead of our expectation, gives us additional confidence in our ability to launch Kwikpen for patients in Europe.
그리고 공급망에는 연중 계획된 세 가지 제품에 대한 승인 등이 필요한 여러 노드가 있으며, 어떤 제품이 어떤 라인에서 실행되는지에 따라 달라집니다. 이제 한 해가 4개월이 지난 지금, 우리는 이러한 노드의 생산 능력에 대한 가시성을 확보하고 더 자신감을 갖게 되었습니다. 한 가지 예로, 예상보다 약간 앞당겨진 유럽에서의 퀵펜 승인은 유럽에서 환자를 위한 퀵펜을 출시할 수 있는 능력에 대한 자신감을 더해주었습니다.
So, it is across our sites globally as well as ramping-up capacity with partners, our CDMOs as well as in existing sites where we're making investments to expand where we can or ramp-up capacity. So, it's across our supply chain.
따라서 전 세계 전 사업장뿐만 아니라 파트너, CDMO와 함께 용량을 늘리고 있으며, 기존 사업장에서도 가능한 곳을 확장하거나 용량을 늘리기 위해 투자하고 있습니다. 즉, 공급망 전반에 걸쳐 이루어지고 있습니다.
Mohit Bansal— Wells Fargo
Great. Thank you very much for taking my question and congrats on the progress. I have a question regarding the pricing. So, if you look at the script trend, it seems like there was a little bit of adverse relationship in the pricing versus fourth quarter. Can you comment on that? And how should we think about the cadence of price-volume over the quarter for the year? Thank you.
잘됐네요. 제 질문을 받아 주셔서 대단히 감사드리며 진행 상황을 축하드립니다. 가격 책정과 관련하여 질문이 있습니다. 스크립트 추이를 보면 4분기 대비 가격이 약간 역전된 것 같은데요. 이에 대해 말씀해 주시겠어요? 그리고 올해 분기별 가격 대비 거래량 추이를 어떻게 생각해야 할까요? 감사합니다.
Patrik Jonsson— Executive Vice President; President, Lilly Diabetes and Obesity; President, Lilly USA
Well, thank you very much, Mohit. When you look at the pricing of Mounjaro, I think it's important to take into account that in the Q4 earnings, we announced a one-time adjustment for Mounjaro in Q4 that was quite significant. So, it was a one-time adjustment in the base of Q4. When we look forward for the first-half of 2024, it's important to have in mind that we also terminated the $25 saving card 6/30/2023, but patients that were on are grandfathered until 6/30/2024. So, that would probably be some benefits during the first-half of 2024 for Mounjaro.
모히트 님, 감사합니다. 마운자로 가격 책정을 볼 때 4분기 실적에서 4분기에 상당히 큰 규모의 일회성 조정이 있었다는 점을 고려하는 것이 중요하다고 생각합니다. 따라서 4분기에 일회성 조정이 있었습니다. 2024년 상반기를 내다볼 때, 25달러 세이빙 카드도 2023년 6월 30일에 종료했지만, 기존에 사용 중이던 환자들은 2024년 6월 30일까지 적용된다는 점을 염두에 두어야 합니다. 따라서 2024년 상반기에는 Mounjaro의 혜택을 받을 수 있을 것입니다.
But from the second-half of this year, we should expect to see typical pricing headwinds for Mounjaro as well.
하지만 올해 하반기부터는 마운자로에도 전형적인 가격 역풍이 불 것으로 예상됩니다.
Umer Raffat— Evercore
Hi, guys. Thanks for taking my question. I wanted to focus a quick second on Part D reimbursement dynamics, if I may. And my question is, will tirzepatide be considered differently than a "weight loss drug to secure Part D reimbursement? And the new indications like sleep apnea, will they be considered an applicable drug and not get lumped up as a broad weight loss drug?" Thank you.
안녕하세요, 여러분. 질문해 주셔서 감사합니다. 파트 D 환급 역학에 대해 잠시 집중하고 싶어서요. 제 질문은 티르제파티드가 '파트 D 환급을 확보하기 위한 체중 감량 약물'과 다르게 고려되나요? 그리고 수면 무호흡증과 같은 새로운 적응증은 적용 가능한 약물로 간주되고 광범위한 체중 감량 약물로 묶이지 않을까요?"라는 질문입니다. 감사합니다.
Patrik Jonsson— Executive Vice President; President, Lilly Diabetes and Obesity; President, Lilly USA
Thank you very much, Umer. I think with the announcement made by the CMS early-April to reimburse comorbidities for obesity based upon the SELECT trial, we're also confident that with the new data that we presented just weeks ago in terms of obstructive sleep apnea that, that's going to be reimbursed in Medicare Part D. And we expect similarly for other comorbidities and the read-out of HFpEF, assuming that's positive and approved, and later on with the MOBILITY mortality outcome study.
감사합니다, Umer. 4월 초 CMS가 SELECT 임상시험을 기반으로 비만에 대한 동반 질환을 급여화하겠다고 발표하면서 몇 주 전에 발표한 폐쇄성 수면 무호흡증에 대한 새로운 데이터도 메디케어 파트 D에서 급여화될 것으로 확신합니다. 다른 동반 질환과 HFpEF의 판독 결과도 마찬가지로 긍정적이고 승인된다면 나중에 MOBILITY 사망률 연구와 함께 급여화될 것으로 예상하고 있습니다.
Still, our true north is really to get the TROA, the Treat and Reduce Obesity Act, passed. And we strongly believe that's not a matter of if, but when. We don't see it likely to pass in 2024, but that is still a small likelihood that, that's going to happen.
하지만 우리의 진정한 목표는 비만 치료 및 감소 법안인 TROA를 통과시키는 것입니다. 그리고 우리는 그것이 '만약'의 문제가 아니라 '언제'의 문제라고 굳게 믿고 있습니다. 2024년에 법안이 통과될 가능성은 낮지만, 통과될 가능성은 여전히 작지 않습니다.
Seamus Fernandez— Guggenheim.
Great. Thanks for the question. So, really just wanted to ask, Dan, as you have assessed the Phase 2 SURMOUNT data in NASH. Just interested to know how you are thinking about those data and the opportunity for tirzepatide in that setting or perhaps if retatrutide remains the right target molecule to move forward there? We've had a lot of speculation around some of the comments from the last quarter, and just trying to firm that up and also when we're likely to see those data? I believe they're expected at EASL, but if that is possible to confirm? Thanks so much.
좋아요. 질문 감사합니다. NASH에 대한 임상 2상 SURMOUNT 데이터를 평가하셨기 때문에 정말 궁금한 점이 있습니다. 이러한 데이터와 해당 환경에서 티르제파타이드의 기회에 대해 어떻게 생각하고 있는지, 아니면 레타트루타이드가 여전히 올바른 표적 분자인지 알고 싶어서요. 지난 분기에 나온 몇 가지 의견에 대해 많은 추측이 있었는데, 이를 확고히 하려고 노력 중이며 언제 해당 데이터를 볼 수 있을까요? EASL에서 예상되는 것으로 알고 있는데 확인이 가능한가요? 감사합니다.
Daniel M. Skovronsky— Executive Vice President; Chief Scientific Officer and President, Lilly Immunology
Yeah. Thanks, Seamus. I'll start with the last part there. Yeah, the abstract was accepted and will be presented at EASL in early June. So, that will be an opportunity to see the full NASH package from that Phase 2 trial. Like we said on the last call, really exciting data. We shared some of the top-line. I think tirzepatide can have a profound effect on this disease. It's a Phase 2 trial. Next steps here are to discuss with the FDA what the best path forward could be for tirzepatide.
그래요 고마워요, 시무스 마지막 부분부터 시작하겠습니다. 네, 초록이 승인되어 6월 초에 EASL에서 발표될 예정입니다. 임상 2상 시험의 전체 NASH 패키지를 볼 수 있는 기회가 될 것입니다. 지난번 통화에서 말씀드렸듯이 정말 흥미로운 데이터입니다. 일부 주요 결과를 공유했습니다. 티르제파타이드가 이 질환에 큰 영향을 미칠 수 있다고 생각합니다. 임상 2상 시험입니다. 다음 단계는 티르제파타이드에 대한 최선의 경로가 무엇인지 FDA와 논의하는 것입니다.
You're pointing out, though, that we have another choice in retatrutide, which, based on biomarker data from earlier studies, could also have a profound effect on this disease, that molecule has the addition of glucagon, which is likely to have additional benefits in the liver. So, important opportunities ahead and good to have options as we go into these discussions with regulators.
하지만 이전 연구의 바이오마커 데이터에 따르면 이 질환에 중대한 영향을 미칠 수 있는 레타트루타이드에는 글루카곤이 추가되어 있어 간에서 추가적인 이점이 있을 수 있는 또 다른 선택지가 있다는 점을 지적하고 계십니다. 따라서 규제 당국과의 논의를 진행할 때 중요한 기회가 열리고 옵션이 있다는 것은 좋은 일입니다.
I think for MASH, like other obesity related or metabolic related diseases, Lilly has a pretty broad portfolio and we'll just continue to push the science to make the best possible medicines for patients.
다른 비만이나 대사 관련 질환과 마찬가지로 MASH도 릴리는 매우 광범위한 포트폴리오를 보유하고 있으며, 환자를 위한 최상의 의약품을 만들기 위해 과학을 계속 발전시켜 나갈 것입니다.
Tim Anderson— Wolfe Research
Well, thank you. You showed a slide, Zepbound has NBRx share market of 57% at end of Q1. That makes it pretty clear that the strongest drug wins. So, on that topic, just your latest thinking on upcoming competitor read-outs and how they'll stack-up to Zepbound on metrics of weight loss and blood sugar? So, specifically CagriSema from Novo and Amgen's 133. I know it's just the best guess, but it's what we get asked to do. Thank you.
감사합니다. 슬라이드를 보여 주셨는데, 1분기 말 기준 Zepbound의 NBRx 시장 점유율은 57%입니다. 이는 가장 강력한 약이 승리한다는 것을 분명히 보여줍니다. 이 주제와 관련하여, 곧 출시될 경쟁 제품에 대한 최근 생각과 체중 감소 및 혈당 측정 지표에서 Zepbound와 어떻게 비교될까요? 특히 노보의 카그리세마와 암젠의 133이 그렇습니다. 최선의 추측일 뿐이라는 것을 알지만, 저희는 그렇게 하도록 요청받았습니다. 감사합니다.
Daniel M. Skovronsky— Executive Vice President; Chief Scientific Officer and President, Lilly Immunology
Yeah. Sure, Tim. It's probably more your job than ours to speculate our competitor read-outs, but I'll take a stab at it since you asked. I think, on AMG 133, we've just seen really a small amount of data. So, probably anything is possible, and -- but like you will be interested to see their results. Of course, there's arguments that can be heard about GIP agonism versus antagonism. We've placed our bets and we like the data we got with the GIP agonism.
그래요 물론이죠, 팀. 경쟁사 판독값을 추측하는 것은 저희보다 팀장님이 더 잘 아시겠지만, 물어보셨으니 제가 한 번 해보겠습니다. 제 생각에는 AMG 133에서는 방금 아주 적은 양의 데이터를 본 것 같습니다. 따라서 아마도 모든 것이 가능하겠지만, 여러분처럼 그 결과를 보고 싶을 것입니다. 물론 GIP 작용 작용과 길항 작용에 대한 논쟁이 있을 수 있습니다. 저희는 GIP 작용 작용에 베팅을 했고, 그 데이터가 마음에 듭니다.
On CagriSema, of course, adding more agonism on different pathways on top of GLP-1 is a good idea. That's what we have with tirzepatide as a dual agonist. So, CagriSema makes sense, and you'll note that we've advanced our amylin agonist into Phase 2. Tirzepatide already is a dual agonist. Retatrutide is already a triple agonist. There's probably more we could do here at Lilly. I think across our portfolio, in Phase 1 and Phase 2, we have nine assets that are marked for diabetes or obesity, many of them could lead to additive weight loss on top of established mechanisms, plus two more in Phase 3, of course. So, we have a strong portfolio here. I think tirzepatide still has unsurpassed efficacy at weight loss, but we're preparing for our next-generation assets as well.
물론 카그리세마에서는 GLP-1 외에 다른 경로에 더 많은 작용제를 추가하는 것이 좋은 생각입니다. 이것이 바로 이중 작용제로서 티르제파타이드가 가진 장점입니다. 따라서 카그리세마는 의미가 있으며, 아밀린 작용제를 2상까지 진행했음을 알 수 있습니다. 티르제파타이드는 이미 이중 작용제입니다. 레타트루타이드는 이미 삼중 작용제입니다. 릴리에서 할 수 있는 일은 더 많을 것입니다. 릴리의 포트폴리오를 보면 1상과 2상에서 당뇨병이나 비만을 대상으로 하는 9개의 자산이 있으며, 이 중 상당수는 기존 메커니즘에 추가적으로 체중 감소를 가져올 수 있고, 물론 3상에는 두 개가 더 있습니다. 따라서 우리는 강력한 포트폴리오를 보유하고 있습니다. 티르제파타이드는 여전히 체중 감량에 탁월한 효능을 가지고 있지만, 차세대 자산도 준비하고 있습니다.
Terence Flynn— Morgan Stanley
Great. Congrats on all the progress. Just was wondering if you can tell us if the IQVIA prescription data is an accurate representation of tirzepatide volumes, or if it's been underrepresented at all given LillyDirect and what you know about how much is flowing through that channel? And if it is underrepresented, can you help quantify any delta for us? Thank you.
잘됐네요. 모든 진전을 축하드립니다. IQVIA 처방 데이터가 티르제파타이드의 양을 정확하게 나타내는지, 아니면 LillyDirect를 통해 얼마나 많은 양이 유입되는지 알고 계신 정보가 과소 대표되는지 알려주실 수 있는지 궁금합니다. 그리고 과소 대표되는 경우 델타를 정량화할 수 있도록 도와주시겠습니까? 감사합니다.
Patrik Jonsson— Executive Vice President; President, Lilly Diabetes and Obesity; President, Lilly USA
Well, thanks very much, Terence. When it comes to LillyDirect, I think we're very pleased with the start. And when we look at the utilization by consumers, it's gaining traction by weeks here. If we look at the TRx data of Q1, particularly for Zepbound, it's relatively low volume that goes through LillyDirect, slightly higher in terms of NBRx. It's our understanding that what goes through LillyDirect is not by default captured by IQVIA. But IQVIA has a methodology in-place to estimate what goes through LillyDirect as well.
테렌스, 정말 감사합니다. 릴리다이렉트의 시작은 매우 만족스럽다고 생각합니다. 그리고 소비자들의 사용률을 보면 몇 주 단위로 점점 더 많은 관심을 받고 있습니다. 특히 젭바운드의 경우 1분기 TRx 데이터를 보면, 상대적으로 LillyDirect를 거치는 거래량은 적고 NBRx는 약간 높습니다. 릴리다이렉트를 거치는 물량은 기본적으로 IQVIA에서 캡처되지 않는 것으로 알고 있습니다. 하지만 IQVIA에는 LillyDirect를 거치는 물량도 추정할 수 있는 방법론이 마련되어 있습니다.
Akash Tewari— Jefferies.
Hey, thanks so much. So, your team presented data on a monotherapy GIP agonist at ADA last year, but it looks like you are moving the amylin into Phase 2. Can you talk about why amylin might be preferred versus GIP as a maintenance regimen for obesity? And how your product could differ versus others when it comes to half-life and preferential agonism versus calcitonin and amylin? Thanks.
안녕하세요, 정말 감사합니다. 작년에 ADA에서 단일 요법 GIP 작용제에 대한 데이터를 발표하셨는데, 아밀린을 2상 임상으로 옮기시는 것 같습니다. 비만 유지 요법으로 GIP보다 아밀린이 선호되는 이유에 대해 말씀해 주시겠습니까? 그리고 칼시토닌과 아밀린에 비해 반감기 및 우선 작용 작용 측면에서 귀사의 제품이 다른 제품과 어떻게 다를 수 있나요? 감사합니다.
Daniel M. Skovronsky— Executive Vice President; Chief Scientific Officer and President, Lilly Immunology
Yeah. There are a lot of good questions in there. Thanks for following science so closely. So, on the GIP, the long-acting molecule, I think primarily in that experiment, we were excited to show the benefits of isolated GIP agonism just to answer some mechanism of action questions around tirzepatide.
네. 좋은 질문이 많네요. 과학에 관심을 가져주셔서 감사합니다. 지속형 분자인 GIP에 대해서는 주로 이 실험에서 티르제파타이드의 작용 메커니즘에 대한 질문에 답하기 위해 분리된 GIP 작용제의 이점을 보여줄 수 있어서 기뻤던 것 같습니다.
But as you point out, there's potential for that molecule for the other indications or as a monotherapy or combination with other mechanisms. But of course, since tirzepatide already includes GIP agonism, we're also excited to explore other mechanisms. So, that's where elora, which is one of nine different mechanisms, as I said a moment ago, that we're exploring the long-acting amylin move forward to Phase 2. That has potential perhaps as a combination therapy, perhaps as a maintenance therapy, perhaps as a monotherapy, there's a lot to explore. It's still very early as it is for all of our mechanisms. So, we'll keep investing. And as we have data to share, we'll do that.
하지만 지적하신 대로 다른 적응증이나 단독 요법 또는 다른 기전과의 병용 요법으로 이 분자가 사용될 가능성이 있습니다. 물론 티르제파타이드에는 이미 GIP 작용제가 포함되어 있기 때문에 다른 기전을 탐색하는 것도 기대됩니다. 그래서 아까 말씀드린 대로 9가지 기전 중 하나인 엘로라가 2상 임상시험을 진행 중이며, 지속형 아밀린도 연구하고 있습니다. 이는 아마도 병용 요법, 유지 요법, 단일 요법으로서 잠재력이 있으며 탐구해야 할 것이 많습니다. 모든 메커니즘에 대해 아직은 매우 초기 단계입니다. 따라서 우리는 계속 투자할 것입니다. 그리고 공유할 데이터가 생기면 그렇게 할 것입니다.
Trung Huynh— UBS.
Yeah. Hi, thanks for my question. Just back on CMS recently broadening its coverage for Wegovy for certain heart conditions. I appreciate you mentioned that TROA is the main goal, but do you expect Zepbound to get added to CMS in a similar way as Wegovy? And yeah, when could this happen? Could this be after the heart failure data in 3Q or do we have to wait for the CVOT data? Thanks very much.
네, 질문 감사합니다. 최근 특정 심장 질환에 대한 Wegovy의 보험 적용 범위를 넓히기 위해 CMS로 돌아왔습니다. TROA가 주요 목표라고 언급해 주셔서 감사하지만, Zepbound도 Wegovy와 비슷한 방식으로 CMS에 추가될 것으로 예상하나요? 그렇다면 언제쯤 가능할까요? 3분기 심부전 데이터 이후일까요, 아니면 CVOT 데이터를 기다려야 할까요? 감사합니다.
Patrik Jonsson— Executive Vice President; President, Lilly Diabetes and Obesity; President, Lilly USA
Thanks, Trung. No, based up on what CMS stated early-April, we actually expect to get obstructive sleep apnea for Zepbound covered by CMS and Medicare at the time of launch. And the next one then would be HFpEF assuming a positive readout and approval. And the third one would be the MMO indication. That's the sequence of our plans, assuming everything goes according to plan and we get the approval for both.
고마워요, Trung. 아니요, CMS가 4월 초에 밝힌 내용에 따르면 실제로 출시 시점에 폐쇄성 수면 무호흡증에 대해 CMS와 메디케어의 보험 적용을 받을 수 있을 것으로 예상하고 있습니다. 그다음은 긍정적인 판독 결과와 승인을 가정할 때 HFpEF가 될 것입니다. 그리고 세 번째는 MMO 적응증입니다. 모든 것이 계획대로 진행되고 두 가지 모두 승인을 받는다는 가정 하에 계획된 순서입니다.
Geoff Meacham— Bank of America
Good morning, guys. Thanks for the question. You guys have been asked on this before, I'm sure, but can you just review the rationale in utilizing the Kwikpen just for outside the U.S. markets like Europe? I wasn't sure why this couldn't apply to the U.S. market and if this also could be a means to relieve capacity looking forward? Thank you.
안녕하세요, 여러분. 질문 주셔서 감사합니다. 이전에도 이와 관련된 질문을 받은 적이 있을 것 같은데, 유럽과 같은 미국 외 시장에만 퀵펜을 활용하는 근거를 검토해 주시겠어요? 왜 미국 시장에는 적용되지 않는지, 그리고 이것이 향후 용량 완화를 위한 수단이 될 수 있는지 잘 모르겠습니다. 감사합니다.
David A. Ricks— Chair and Chief Executive Officer
Yeah. Sure. And Ilya can add to this. As we think -- we've said on several calls now, our goal is to pursue all of the above, basically, as it relates to supply options, recognizing the tremendous demand and unmet need and the constraints that exist in scaling the supply chain. So, Kwikpen uses existing assets. So, there was less time lag. We pursued this first in the U.K. and now in Europe as a way to meet the needs of those patients. But we haven't ruled it out in other jurisdictions. And so, we'll continue to look at every option we can to meet the needs of patients with obesity and overweight as well as with diabetes.
그래요 네. 일리야가 덧붙일 수 있습니다. 지금까지 여러 차례 통화에서 말씀드렸듯이, 우리의 목표는 기본적으로 공급 옵션과 관련하여 엄청난 수요와 미충족 수요, 공급망 확장에 존재하는 제약을 인식하고 위의 모든 것을 추구하는 것입니다. 그래서 퀵펜은 기존 자산을 활용합니다. 따라서 시간 지연이 적었습니다. 우리는 이러한 환자들의 요구를 충족시키기 위한 방법으로 영국과 유럽에서 먼저 이를 추진했습니다. 하지만 다른 관할권에서도 이 방법을 배제하지 않았습니다. 따라서 당뇨병뿐만 아니라 비만 및 과체중 환자의 요구를 충족하기 위해 가능한 모든 옵션을 계속 검토할 것입니다.
Kerry Holford— Berenberg.
Oh, hi. I'm going to take a different topic here. Looking at LP(a), your new product, you've now said that you're taking into Phase 3. Can you confirm whether you published any Phase 2 data? I haven't found any. So, if I'm correct there, when might we see that published?
안녕하세요, 다른 주제를 다뤄보겠습니다. 신제품인 LP(a)를 보면 이제 3상 단계에 접어들었다고 하셨는데요. 2상 데이터를 발표했는지 확인해주실 수 있나요? 아직 찾지 못했습니다. 그렇다면 제 말이 맞다면 언제쯤 발표될 수 있을까요?
And can you confirm what dose and frequency of administration you're looking at for that Phase 3 study? And, I guess, as you appear to be positioned third in that race, would be interested to hear how you expect your drug to be differentiated versus the competitor, that's already in Phase 3? Thank you.
그리고 그 3상 연구에서 어떤 용량과 투여 빈도를 고려하고 있는지 확인해 주실 수 있나요? 그리고 해당 경쟁에서 3위를 차지하고 있는 것으로 보이는데, 이미 3상에 진입한 경쟁약과 비교하여 어떤 차별화를 기대하고 계신지 궁금합니다. 감사합니다.
Daniel M. Skovronsky— Executive Vice President; Chief Scientific Officer and President, Lilly Immunology
Yeah. Thanks, Kerry, for the good questions here. You're right, we haven't yet published the Phase 2 data. And I think we just recently were able to publish a Phase 1 data, and that was really exciting and well-received. I think one of the things that people noted in our Phase 1 data was a very long durability of action and the very deep reduction in LP(a) levels, following a single-dose of lepodisiran.
네. 좋은 질문 감사합니다, 케리. 맞아요, 아직 임상 2상 데이터를 발표하지 않았습니다. 최근에 1상 데이터를 발표할 수 있었는데 정말 흥미롭고 호평을 받았습니다. 임상 1상 데이터에서 사람들이 주목한 것 중 하나는 레포디시란을 단회 투여한 후 매우 긴 작용 지속 시간과 LP(a) 수치가 매우 크게 감소했다는 점이라고 생각합니다.
We now have, of course, a Phase 2 data in-hand and use that to design and begin the Phase 3 trial. I think we haven't quite disclosed dose or frequency yet, but I'm sure that will happen in time.
물론 현재 2상 데이터를 확보하고 있으며 이를 바탕으로 3상 임상시험을 설계하고 시작하고 있습니다. 아직 용량이나 빈도는 공개하지 않았지만 조만간 공개할 수 있을 것으로 생각합니다.
You asked about differentiation. I think there's probably a couple of different potentials for differentiation here versus a shorter-acting ASO and a siRNA that are both in Phase 3 studies. Maybe first is the depth of clearance of LP(a), we don't know-how much you have to reduce LP(a) to lead to benefits in cardiovascular outcomes and whether there's a threshold effect or a floor to this. So, the depth of clearance is one. The second, as you asked about, could be frequency of administration or durability of action, those two being closely linked.
차별화에 대해 질문하셨습니다. 현재 임상 3상 연구 중인 속효성 ASO 및 siRNA와 비교했을 때 차별화할 수 있는 몇 가지 가능성이 있다고 생각합니다. 아마도 첫 번째는 LP(a)의 제거 깊이일 것입니다. 우리는 LP(a)를 얼마나 줄여야 심혈관 결과에 이점이 있는지, 그리고 이에 대한 역치 효과 또는 바닥이 있는지에 대해 알지 못합니다. 그래서 첫 번째는 간격의 깊이입니다. 두 번째는 질문하신 대로 투여 빈도 또는 작용 지속 시간일 수 있으며, 이 두 가지는 밀접하게 연관되어 있습니다.
And the third, of course, is the population that's being studied, and I noted we're studying secondary as well as primary prevention here. So, I think we have a good package with multiple opportunities for differentiation and eager to test the LP(a) hypothesis here in this Phase 3 study.
세 번째는 물론 연구 대상 인구이며, 여기서 1차 예방뿐만 아니라 2차 예방도 연구하고 있다고 언급했습니다. 따라서 이번 3상 연구에서는 여러 가지 차별화 기회가 있는 좋은 패키지를 갖추고 있으며, LP(a) 가설을 테스트하고자 합니다.
Steve Scala— TD Cowen
Thank you very much. Given that based on all available metrics, the surpassed CVOT interim likely already has passed. Can you confirm that the only way the trial would have stopped is if there were either a survival benefit or futility and not simply non-inferiority? And anything you can say regarding your confidence in eventually hitting superiority based on what you know so far? Thank you.
대단히 감사합니다. 사용 가능한 모든 지표를 고려할 때 CVOT 중간값을 초과한 것은 이미 지나갔을 가능성이 높습니다. 임상시험을 중단할 수 있는 유일한 방법은 단순히 비열등성이 아니라 생존 혜택이 있거나 무용성이 있는 경우라는 점을 확인해 주시겠습니까? 그리고 지금까지 알고 있는 내용을 바탕으로 최종적으로 우월성에 도달할 수 있다는 자신감에 대해 말씀해 주실 수 있나요? 감사합니다.
Daniel M. Skovronsky— Executive Vice President; Chief Scientific Officer and President, Lilly Immunology
Sure. Thanks, Steve. As you know, we do our best not to comment on interim analyses, although many of our different trials can incorporate interim analyses. But when we do talk about the risks, unintentional, unblinding of results, and for that reason, we prefer not to do that.
네, 감사합니다, 스티브. 아시다시피, 저희는 중간 분석에 대해 언급하지 않기 위해 최선을 다하고 있지만, 다양한 시험에 중간 분석이 포함될 수 있습니다. 하지만 의도치 않게 결과가 왜곡될 수 있는 위험에 대해 언급하는 것은 바람직하지 않다고 생각하기 때문입니다.
You're right that the primary analysis of the study and the design is around non-inferiority versus what we are ready to know to be a very good drug that reduces cardiovascular risk and that's Trulicity. So, it's designed as a non-inferiority trial. Of course, when the final data come, we would be delighted to see even superiority.
심혈관 위험을 감소시키는 매우 좋은 약물로 알려진 트루리시티의 비열등성과 비교하는 것이 연구의 주요 분석 및 설계라는 말씀이 맞습니다. 따라서 비열등성 시험으로 설계되었습니다. 물론 최종 데이터가 나오면 우월성이 입증된다면 더할 나위 없이 기쁠 것입니다.
You asked about our confidence. Confidence continues to increase for this readout. In fact, as disclosed in the prepared remarks today, we got additional data here even from the OSA study that should make us feel more confident, not just the benefit of sleep apnea, which itself could lead to cardiovascular benefits, but actually the weight loss. And I think there are some concerns about weight loss in different populations in different trials, and males, females, etc. So, some of that was discharged here. So, remain excited and look forward to getting that data when studies complete.
저희의 자신감에 대해 질문하셨습니다. 이 결과에 대한 자신감은 계속 높아지고 있습니다. 실제로 오늘 준비된 발언에서 공개했듯이 수면무호흡증 자체가 심혈관계 이점을 가져올 수 있다는 것뿐만 아니라 실제로 체중 감소에 대한 추가 데이터도 얻었기 때문에 더욱 자신감을 가질 수 있습니다. 그리고 다른 임상시험의 다른 인구 집단, 남성, 여성 등의 체중 감소에 대한 몇 가지 우려가 있다고 생각합니다. 그래서 그 중 일부가 여기에 공개되었습니다. 그러니 기대감을 갖고 연구가 완료되면 그 데이터를 기대해 주세요.
Evan Seigerman— BMO Capital Markets
Hi, all. Thank you so much for taking my question. I wanted to touch on donanemab. With the AdCom approaching, can you discuss how your -- if your confidence has changed in the asset? And maybe any specific points that you will hope will be addressed during this discussion with these outside experts? Thank you so much.
안녕하세요. 제 질문을 받아 주셔서 감사합니다. 도나넴맙에 대해 말씀드리고 싶었습니다. 애드컴이 다가옴에 따라 자산에 대한 자신감이 어떻게 변했는지 설명해 주시겠어요? 그리고 이 외부 전문가들과의 토론에서 다루어지기를 바라는 구체적인 사항이 있을까요? 감사합니다.
Anne E. White— Executive Vice President and President, Lilly Neuroscience
Yeah. Thanks so much for the question, and we are incredibly confident in donanemab's potential and the fact that offers very meaningful benefits to people with early symptomatic Alzheimer's disease, and just the overall approvability of the package. We do look forward to seeing those questions. We haven't received those yet. I think that what we'll anticipate really is discussions around the safety and efficacy of donanemab.
네. 질문해 주셔서 정말 감사드리며, 저희는 도나네맙의 잠재력과 초기 증상이 있는 알츠하이머병 환자에게 매우 의미 있는 혜택을 제공할 수 있다는 사실과 패키지의 전반적인 승인 가능성에 대해 매우 확신하고 있습니다. 이러한 질문을 기다리고 있습니다. 아직 그런 질문은 받지 못했습니다. 도나넴맙의 안전성과 효능에 대한 논의가 주로 이루어질 것으로 예상됩니다.
And those -- the safety and efficacy profile remain very consistent with what we published and presented. So, nothing new there. We do expect there's a couple of unique aspects to our trial that we anticipate they'll want to discuss. One is around limited duration dosing. We think this is an incredibly important feature of donanemab, the chance to stop dosing when you've cleared the plaques, and donanemab clears them robustly and rapidly. So, we think that allows for this limited duration dosing approach. So, we really do look forward to getting into that data and having the advisors see that and respond to it.
그리고 안전성과 효능 프로필은 저희가 발표하고 제시한 내용과 매우 일관되게 유지되고 있습니다. 따라서 새로운 내용은 없습니다. 하지만 이번 임상시험에는 몇 가지 독특한 측면이 있을 것으로 예상됩니다. 하나는 제한된 기간 동안의 투약에 관한 것입니다. 플라크가 제거되면 투약을 중단할 수 있고, 도나넴맙은 강력하고 빠르게 플라크를 제거하기 때문에 이것이 도나넴맙의 매우 중요한 특징이라고 생각합니다. 그래서 저희는 이 제한된 기간의 투약 접근법이 가능하다고 생각합니다. 따라서 저희는 이 데이터를 통해 의료진이 이를 확인하고 이에 대응할 수 있기를 기대합니다.
Another unique aspect is assessing tau at baseline. This is important for the field, so that we understand the prognostic factor of tau, and that was able to be firmed. But what we saw in the trial was all patients benefited regardless of tau level, with those early in the disease doing even better. It's one of the reasons that we remain so enthusiastic about TRAILBLAZER-3. And while Dan did mention it in his remarks, I think, we remain and get even more enthusiastic about the opportunity to intervene earlier based on what we saw in that early population, the people with low tau and those that had no tau with such strong biomarker results.
또 다른 독특한 측면은 베이스라인에서 타우를 평가하는 것입니다. 이는 타우의 예후 인자를 이해하기 위해 현장에서 매우 중요한 부분이며, 이를 통해 타우의 예후 인자를 확고히 할 수 있었습니다. 하지만 임상시험에서 확인한 것은 타우 수치에 관계없이 모든 환자가 혜택을 받았으며, 질병 초기의 환자들은 더 좋은 결과를 보였습니다. 이것이 바로 우리가 트레일블레이저-3에 열광하는 이유 중 하나입니다. 그리고 댄의 발언에서도 언급했지만, 초기 환자군, 즉 타우가 낮은 환자군과 타우가 없는 환자군에서 강력한 바이오마커 결과가 나온 것을 바탕으로 조기에 개입할 수 있는 기회에 대해 더욱 열정을 갖고 있습니다.
I think you probably remember the data that patients in the earliest part of our study had a 60% slowing and we believe that could be even stronger as you get into the earlier patients that are pre-clinical.
연구 초기 환자의 속도가 60% 느려졌다는 데이터를 기억하실 것 같고, 전임상 단계의 초기 환자로 갈수록 그 속도가 더 빨라질 수 있다고 생각합니다.
And maybe just one remark. In the meantime, though, this is not time lost, we'll continue to make sure the healthcare system is ready. We're going to make sure that we launch into an even stronger market with potential approval. So, we're making the most of this time and look forward to the outcome, as Dan said, in mid-'24, and answering any questions that they have.
그리고 한 마디만 덧붙이겠습니다. 하지만 그 동안에도 시간을 허비하지 않고 의료 시스템을 준비해 나갈 것입니다. 잠재적인 승인을 통해 더욱 강력한 시장으로 진출할 수 있도록 할 것입니다. 따라서 저희는 이 시간을 최대한 활용하고 있으며, 댄이 말한 대로 24년 중반에 결과가 나올 것으로 기대하고 있습니다.
David Risinger— Leerink Partners
Thanks very much. And let me add my congrats on the progress and the guidance raised. So, my question is on orforglipron. Novo Nordisk has raised some concerns about the scalability of orforglipron manufacturing given its complexity. I haven't spoken to Novo directly, but someone told me that they mentioned there are 35 steps in the process. I don't know if that's true, but could you please discuss how Lilly is building-out its manufacturing capacity and whether the Company expects to be able to meet global demand in the Western world after launch in 2026, or whether we, the investment community, should expect supply constraints and should be guarded about how we try to model orforglipron's ramp after launch? Thank you.
대단히 감사합니다. 그리고 진행 상황과 제기 된 지침에 대해 축하를 보냅니다. 오르글리프론에 관한 질문입니다. 노보 노디스크는 오르글리프론의 복잡성을 고려할 때 제조의 확장성에 대한 우려를 제기했습니다. 노보 측과 직접 이야기해 보지는 않았지만, 누군가가 그 과정에 35개의 단계가 있다고 언급했다고 들었습니다. 사실인지는 모르겠지만 릴리가 제조 역량을 어떻게 구축하고 있는지, 2026년 출시 후 서구권에서 글로벌 수요를 충족할 수 있을 것으로 예상하는지, 아니면 우리 투자 커뮤니티가 공급 제약을 예상하고 출시 후 오르글리프론의 램프 모델을 어떻게 시도할지 경계해야 하는지에 대해 논의해 주시겠습니까? 감사합니다.
David A. Ricks— Chair and Chief Executive Officer
Okay. Great, Dave. Great to hear from you. I mean, first of all, it is true that our orforglipron is a complicated large -- small molecule, a large small molecule, if you were, and there are many steps in the process. You can read about them in our patent filings, I think. But Lilly, maybe unlike other companies, we made small molecules for a long time. We're capable of doing it. We understand how to put them together, and we've got a defined process to do it for orforglipron.
알았어요 좋아요, 데이브 연락주셔서 감사합니다. 우선, 저희 오르포글리프론은 복잡한 대분자, 소분자, 큰 소분자이고 그 과정에 많은 단계가 있는 것은 사실입니다. 특허 출원서에서 이에 대해 읽어보실 수 있을 겁니다. 하지만 릴리는 다른 회사들과 달리 오랫동안 저분자를 만들어 왔습니다. 우리는 할 수 있습니다. 우리는 그것들을 조합하는 방법을 이해하고 있으며 오르글리프론을 위해 이를 수행하는 정의된 프로세스를 가지고 있습니다.
So, the API production, well, a long process and maybe complicated relative to other small molecules is something we're super confident in and have our arms around. The finish process is really the big advance over using injectables, because, here, we're just tablet stamping or tablet -- capsule making, which are dry processes, we understand extremely well.
따라서 API 생산은 다른 소분자에 비해 공정이 길고 복잡할 수 있지만, 우리가 매우 자신 있고 잘 할 수 있는 분야입니다. 정제 스탬핑이나 정제 캡슐 제조와 같은 건식 공정은 우리가 매우 잘 이해하고 있기 때문에 마무리 공정은 주사제를 사용하는 것보다 정말 큰 발전입니다.
I think the big gain here will be the fact that both for synthetic chemistry and capsule making and tablet making, there is already capacity on planet Earth that is significant. And so, unlike the parenteral side where we've been talking about injectables and new capacity needs to be built, in which, we're doing aggressively, as Anat commented on earlier, here, there's a lot of partners we can access as well as our own substantial network or dry product, fill finish and API production. So, pretty confident here.
여기서 큰 이득은 합성 화학 및 캡슐 제조와 정제 제조 모두에서 이미 지구상에 상당한 생산 능력이 있다는 사실이라고 생각합니다. 따라서 주사제에 대해 이야기하고 새로운 용량을 구축해야 하는 비경구용 분야와는 달리, 아까 Anat가 언급했듯이 이 분야에서는 상당한 네트워크나 건조 제품, 충전 마감 및 API 생산뿐만 아니라 우리가 접근할 수 있는 파트너가 많이 있기 때문에 공격적으로 하고 있습니다. 그래서 꽤 자신 있습니다.
Now, will we stick the landing on exact doses and quantities in every instance? We're not guaranteeing that, but I think the picture will be quite a bit different should orforglipron prove to be safe and effective in the Phase 3 studies. Again, that's in 2025. So, we can expect launch maybe a year after that, and that's an important event in the time course of the incretin class.
이제 모든 경우에 정확한 용량과 양을 정할 수 있을까요? 장담할 수는 없지만, 3상 임상시험에서 오르포글리프론의 안전성과 효과가 입증된다면 상황은 상당히 달라질 것이라고 생각합니다. 다시 말하지만, 2025년입니다. 따라서 출시는 그보다 1년 후에나 가능할 것으로 예상할 수 있으며, 이는 인크레틴 계열의 시간 경과에서 중요한 사건입니다.
Louise Chen— Cantor
Hi. Thanks for taking my question. I just wanted to ask you about your next wave of obesity drug. It looks like you're about half a dozen of these in development. And where do you think you can most differentiate yourself? Thank you.
안녕하세요, 질문해주셔서 감사합니다. 다음 비만 치료제에 대해 물어보고 싶어서요. 현재 개발 중인 약물이 6개 정도 되는 것 같은데요. 어떤 부분에서 가장 차별화할 수 있다고 생각하시나요? 감사합니다.
Daniel M. Skovronsky— Executive Vice President; Chief Scientific Officer and President, Lilly Immunology
Yeah. Thanks, Louise. We're excited about the portfolio of earlier-stage obesity molecules. I think there's a number of opportunities for improvement over even an excellent drug like tirzepatide. We think about the quality of weight loss as one aspect. So, for example, even on tirzepatide, we see the ratio of lean to fat mass improve as patients lose weight on these drugs. Could we make it improve even faster with the muscle stimulating agents like bimagrumab? Maybe, that's under investigation.
네 고마워요, 루이스. 저희는 초기 단계의 비만 분자 포트폴리오에 대해 기대하고 있습니다. 티르제파타이드와 같은 우수한 약물도 개선할 수 있는 기회가 많다고 생각합니다. 우리는 체중 감소의 질을 한 가지 측면으로 생각합니다. 예를 들어, 티르제파타이드를 사용하더라도 환자가 이 약으로 체중을 감량하면 제지방량 대 체지방량의 비율이 개선되는 것을 볼 수 있습니다. 비마그루맙과 같은 근육 자극제를 사용하면 더 빠르게 개선할 수 있을까요? 현재 연구 중입니다.
Tirzepatide is very well tolerated, but some people stop taking it because of GI side effects. Could we have drugs that have fewer side effects? But maybe that could be possible. Tirzepatide is given as a once a weekly injection, and most patients find that to be acceptable, but probably with less frequent injections that could lower the burden on manufacturing and make it easier to use for patients. So, that's another avenue of exploration. There are some patients who don't achieve their desired levels of weight loss even on a powerful drug like tirzepatide, and so that's another avenue.
티르제파타이드는 내약성이 매우 우수하지만 일부 사람들은 위장관계 부작용으로 인해 복용을 중단하기도 합니다. 부작용이 더 적은 약이 있을까요? 아마도 가능할지도 모릅니다. 티르제파타이드는 일주일에 한 번 주사로 투여하는데, 대부분의 환자들이 이 정도는 괜찮다고 생각하지만 주사 횟수를 줄이면 제조에 대한 부담을 줄이고 환자들이 더 쉽게 사용할 수 있을 것입니다. 이것이 또 다른 탐색의 길입니다. 티르제파티드와 같은 강력한 약물을 사용해도 원하는 수준의 체중 감량에 도달하지 못하는 환자들도 있으므로 이 또한 또 다른 방법 중 하나입니다.
Finally, across different indications, and I spoke earlier of NASH, that are related to metabolic disease. There could be different activities that proved more or less beneficial for these other related diseases. So, that's another avenue of differentiation. I think we're just at the beginning of probably what will be seen as a multi-decade investments in treating abnormal metabolism and all diseases that come with that. And I'm really proud and pleased that Lilly has what must be the strongest pipeline in this area in the industry.
마지막으로, 대사성 질환과 관련된 다양한 적응증에 걸쳐, 앞서 말씀드린 NASH에 대해 말씀드렸습니다. 이러한 다른 관련 질환에 대해 어느 정도 효과가 있는 것으로 입증된 다양한 활동이 있을 수 있습니다. 이것이 또 다른 차별화의 길입니다. 저는 우리가 비정상적인 신진대사와 그에 수반되는 모든 질병을 치료하기 위한 수십 년에 걸친 투자의 시작에 불과하다고 생각합니다. 그리고 저는 릴리가 이 분야에서 업계에서 가장 강력한 파이프라인을 보유하고 있다는 사실이 정말 자랑스럽고 기쁘게 생각합니다.
Chris Shibutani— Goldman Sachs
Great. Thank you. Wanted to ask about the supply and dynamic and the demand and when those two might come closer together. Previously, Anat, you've been quite specific in your vocabulary in saying that, that was something that could possibly happen in 2025. Dave, you were in front of a group that we hosted and I think you gave a little bit of a broader range. What's the latest that you would like to communicate based upon all the progress that you're making, the acquisition of Wisconsin facility, etc., about a potential timing for that supply-demand dynamic to come closer together?
좋아요. 감사합니다. 공급과 수요의 역학 관계와 이 두 가지가 언제쯤 가까워질 수 있는지 물어보고 싶었습니다. 아나트, 이전에는 2025년에 일어날 수 있는 일이라고 꽤 구체적으로 말씀하셨었는데요. 데이브, 우리가 주최한 그룹 앞에서 조금 더 넓은 범위의 이야기를 해주신 것 같습니다. 현재 진행 중인 모든 진전 사항과 위스콘신 시설 인수 등을 바탕으로 공급과 수요의 역학 관계가 더 가까워질 수 있는 잠재적 시기에 대해 가장 최근에 말씀해 주실 수 있는 것은 무엇인가요?
Anat Ashkenazi— Executive Vice President and Chief Financial Officer
Yeah. Let me start on this. So, I would say that, as I said in my prepared remarks, we expect that the supply-demand situation will remain quite tight in the near-term as well as the mid-term. And just to clarify, it's not that we have a production issue or manufacturing facilities are progressing incredibly well, and I'm incredibly proud of the work done by our M&Q colleagues around the world. Clearly, we have sites working 24/7. We're doing construction overnight. We're making the right investments to ensure we're progressing rapidly, as you've seen evidence by the results as well as the raise we did for the year.
그래요 이 부분부터 말씀드리겠습니다. 그래서 제가 준비된 발언에서 말씀드린 것처럼 단기적으로도 중기적으로도 수급 상황이 상당히 타이트하게 유지될 것으로 예상하고 있다는 점을 말씀드리고 싶습니다. 그리고 분명히 말씀드리자면, 생산에 문제가 있거나 제조 시설이 엄청나게 잘 진행되고 있는 것은 아니며, 전 세계 M&Q 동료들이 하는 일에 대해 매우 자랑스럽게 생각합니다. 분명한 것은 24시간 연중무휴로 일하는 현장이 있다는 것입니다. 밤새 공사를 진행하고 있습니다. 올해 실적과 인상률에서 보셨듯이 우리는 빠르게 발전할 수 있도록 적절한 투자를 하고 있습니다.
But the demand is strong, which shouldn't be a surprise given the health benefits that these products provide to patients, highly efficacious and safe medicines. And I expect that this will continue through the year, even with the significant ramp that we have and we'll add more supply across different presentations, both with the auto-injector as well as the Kwikpen. But even with that, I expect that the demand will be -- will outpace supply through this year, potentially next year, obviously, we'll see. We'll continue to invest and ramp as we go into next year, but it could be quite some time.
그러나 이러한 제품이 환자에게 제공하는 건강상의 이점, 매우 효과적이고 안전한 의약품을 고려할 때 수요가 강하다는 것은 놀라운 일이 아닙니다. 그리고 이러한 추세는 올해 내내 지속될 것으로 예상되며, 자동 주사기와 퀵펜을 통해 다양한 프레젠테이션에서 공급량을 늘릴 예정입니다. 하지만 그럼에도 불구하고 올해까지는 수요가 공급을 앞지를 것으로 예상하고 있으며, 내년에는 분명히 지켜봐야 할 것입니다. 내년에도 계속 투자하고 생산량을 늘릴 예정이지만 꽤 오랜 시간이 걸릴 수도 있습니다.
We talked earlier about orforglipron, should we have positive Phase 3 readout that provides another relief valve in terms of just offering a different presentation, as Dave mentioned, which utilizes a different set of infrastructure within our manufacturing organization, available capacity globally. So, it will be in a step-wise fashion. We'll continue to update investors as we progress through the year and coming years.
앞서 오르포글리프론에 대해 말씀드렸듯이, 데이브가 언급한 것처럼 제조 조직 내의 다른 인프라, 전 세계의 가용 용량을 활용하는 다른 릴리프 밸브를 제공한다는 측면에서 3단계 판독 결과가 긍정적으로 나온다면 또 다른 릴리프 밸브를 제공할 수 있을 것입니다. 따라서 단계적인 방식으로 진행될 것입니다. 올해와 향후 몇 년 동안 진행 상황에 따라 투자자들에게 계속 업데이트할 예정입니다.
Carter Gould— Barclays.
Great. Thanks. Good morning. Congrats on all the progress. I wanted to dive into bimagrumab ahead of the Phase 2b data forthcoming. And can you talk for a bit around the importance of showing stat-sig or clear dose response across the composition of the weight loss drivers and maybe as well as the importance of not blunting the overall weight loss as you contemplate a move to Phase 3 potentially? Thank you.
좋아요. 고마워요 좋은 아침입니다. 모든 진전을 축하드립니다. 곧 발표될 임상 2b상 데이터를 앞두고 비마그루맙에 대해 자세히 알아보고 싶었습니다. 그리고 체중 감량 동인의 구성 전반에 걸쳐 통계적 징후 또는 명확한 용량 반응을 보이는 것의 중요성과 잠재적으로 3상 전환을 고려할 때 전반적인 체중 감소를 둔화시키지 않는 것의 중요성에 대해 잠시 이야기해 주시겠습니까? 감사합니다.
Daniel M. Skovronsky— Executive Vice President; Chief Scientific Officer and President, Lilly Immunology
Yeah. Thanks, Carter. It's a good question. Bimagrumab is a very different mechanism of weight loss versus incretins, but one that we think could be important in combination with incretins. So, bimagrumab, we think, will likely have important effects on adipose tissue as well as muscle mass. And so, our hope is to see increased muscle mass and increased ratio, I should say, of lean to fat mass by combining bimagrumab with incretins.
그래 고마워, 카터 좋은 질문이네요. 비마그루맙은 인크레틴과는 매우 다른 체중 감량 메커니즘을 가지고 있지만 인크레틴과 함께 사용하면 중요할 수 있다고 생각합니다. 따라서 비마그루맙은 근육량뿐만 아니라 지방 조직에도 중요한 영향을 미칠 것으로 생각됩니다. 따라서 비마그루맙과 인크레틴을 병용하여 근육량을 늘리고 근육량 대 지방량의 비율을 높이는 것이 저희의 희망입니다.
In this present study, it's being evaluated both as monotherapy and combination with semaglutide at different doses. So, we'll see if weight loss effects on fat tissue stack, and we'll see if effects on lean body mass that we're seeing in previous bimagrumab monotherapy studies work in combination with incretin. Looking forward to seeing that data.
이 현재 연구에서는 단독 요법과 세마글루타이드와의 병용 요법을 다양한 용량으로 평가하고 있습니다. 따라서 지방 조직 중첩에 대한 체중 감소 효과와 이전 비마그루맙 단독 요법 연구에서 확인된 제지방량 감소 효과가 인크레틴과 병용할 때 효과가 있는지 확인할 것입니다. 그 데이터를 기대하고 있습니다.
Kripa Devarakonda— Truist
Hey, guys. Thank you much for taking my question and congrats on all the progress. I have a question about your radio pharma pipeline. You mentioned PNT2002 [Phonetic] in your oncology pipeline. Can you talk about how you see that advancing? And given what you've seen so far, where you see this being placed in the landscape in terms of market share? Thank you.
안녕하세요. 제 질문을 받아 주셔서 감사드리며 모든 진전을 축하드립니다. 무선 제약 파이프라인에 대해 질문이 있습니다. 종양학 파이프라인에서 PNT2002를 언급하셨습니다. 어떻게 진행되고 있다고 보시는지 말씀해 주시겠어요? 그리고 지금까지의 상황을 고려할 때 시장 점유율 측면에서 이 파이프라인이 어느 위치에 있다고 보시나요? 감사합니다.
Jacob Van Naarden— Executive Vice President and President, Loxo@Lilly
Yeah, happy to. Thanks for the question. We're really excited about bringing radiopharmaceuticals into the portfolio by way of the acquisition of POINT Biopharma, and we are supplementing that acquisition with additional work through our discovery labs and the ability to make these medicines ourselves. So, I expect we'll have more to talk about in terms of additional medicines over the course of the next couple of years in addition to PNT2001.
네, 기꺼이 도와드리겠습니다. 질문 감사합니다. 포인트 바이오파마 인수를 통해 방사성 의약품을 포트폴리오에 추가하게 되어 매우 기쁘게 생각하며, 발견 연구소를 통한 추가 작업과 이러한 의약품을 직접 만들 수 있는 능력으로 인수를 보완하고 있습니다. 따라서 향후 몇 년 동안 PNT2001 외에도 추가적인 의약품에 대해 더 많은 이야기를 나눌 수 있을 것으로 예상합니다.
But specific to that question, 2001 is a PSMA-directed therapy for prostate cancer conjugated to actinium, the alpha emitter. And I think while the actinium holds a lot of promise over lutetium, particularly in the context of creating double-stranded DNA breaks versus single stranded and the ability to perhaps drive more efficacy for patients with prostate cancer.
하지만 그 질문과 관련하여 2001은 알파 방출자인 악티늄과 결합된 전립선암에 대한 PSMA 유도 치료법입니다. 액티늄은 루테튬에 비해 많은 가능성을 가지고 있지만, 특히 단일 가닥이 아닌 이중 가닥의 DNA를 끊는다는 점과 전립선암 환자에게 더 많은 효능을 가져올 수 있다는 점에서 더 많은 가능성을 가지고 있다고 생각합니다.
I think one of the limitations of the existing agents is that they probably cause too much salivary gland toxicity to be real durable products. And so, the POINT team designed a novel PSMA-directed ligand with increased tumor uptake relative to the salivary gland in order to drive more therapeutic index using actinium as the payload.
기존 약제의 한계 중 하나는 침샘 독성이 너무 심해 실제 지속성 약물이 되기에는 한계가 있다고 생각합니다. 그래서 POINT 팀은 악티늄을 페이로드로 사용하여 더 많은 치료 지표를 유도하기 위해 침샘에 비해 종양 흡수가 증가된 새로운 PSMA 유도 리간드를 설계했습니다.
So, we're just getting started with the Phase 1 experience right now. So, I don't have a lot to say about what we're seeing just yet. But the preclinical package looked really interesting and differentiated from the other PSMA ligands that exist out there. So, we're looking forward to putting it through its Phase 1 paces, and we'll see what we have. Depending on the clinical profile, I think there's the potential to improve outcomes in patients that have already seen a lutetium based agent, maybe go ahead of that and compete with the lutetium based agents or perhaps even go even earlier in therapy as PSMA expression really exists in the continuum of prostate cancer care. So, more to come on that as we define the clinical profile in the Phase 1.
이제 막 1단계 경험을 시작하고 있는 단계입니다. 그래서 아직은 우리가 보고 있는 것에 대해 할 말이 많지 않습니다. 하지만 전임상 패키지는 매우 흥미롭고 기존의 다른 PSMA 리간드와는 차별화되어 보였습니다. 그래서 임상 1상을 진행하면서 어떤 결과가 나올지 지켜볼 예정입니다. 임상 프로파일에 따라 이미 루테튬 기반 치료제를 받은 환자들의 치료 결과를 개선할 수도 있고, 그보다 앞서서 루테튬 기반 치료제와 경쟁할 수도 있으며, 전립선암 치료의 연속성에서 PSMA 발현이 실제로 존재하므로 치료 초기에 치료할 수도 있다고 생각합니다. 임상 1상에서 임상 프로필을 정의하는 과정에서 더 많은 정보가 나올 예정입니다.
James Shin— Deutsche Bank
Hey, good morning, guys. Thanks for the question. I just wanted to try and reconcile the guidance lift with the 1.5 times saleable doses being maintained. Thank you.
안녕하세요, 여러분. 질문 주셔서 감사합니다. 판매 가능 용량의 1.5배를 유지하면서 가이드 리프트를 조정하려고 합니다. 감사합니다.
Anat Ashkenazi— Executive Vice President and Chief Financial Officer
Yeah. So, let's start with the 1.5 dose -- saleable dose comment that I've made on the guidance call in February. So, that reference is not a number of devices, but number of saleable doses. And as we ramp up capacity for Kwikpen, recall that unlike the single-use vial or the auto-injector, that Kwikpen is a multi-dose device that has multiple dose available for patients. That comment referred to the second half of this year versus the second half of last year. So, we're expecting that total saleable doses this year in the second half will be at least 1.5 times where we were second half of last year. That remains unchanged.
네. 2월에 제가 안내 통화에서 말씀드린 1.5회 용량, 즉 판매 가능한 용량에 대한 언급부터 시작하겠습니다. 따라서 이 기준은 디바이스 수가 아니라 판매 가능한 용량 수입니다. 그리고 퀵펜의 용량을 늘릴 때 일회용 바이알이나 자동 주입기와 달리 퀵펜은 환자에게 여러 용량을 투여할 수 있는 다중 용량 기기라는 점을 기억해 주세요. 이 발언은 작년 하반기와 올해 하반기를 비교한 것입니다. 따라서 올해 하반기 총 판매 가능 용량은 작년 하반기의 1.5배 이상이 될 것으로 예상하고 있습니다. 이는 변함없이 유지됩니다.
But the level of confidence we have in our ability to progress on each node of our capacity that's coming online or will get approved, etc., has just increased. There are multiple of these throughout the year. Multiple of these have occurred. Some will occur, as I gave the Kwikpen as one example. Think about a construction of a site, for example, Concord in North Carolina, which we said will become operational by end of the year, and we'll start seeing products next year. That construction has concluded. Lines are installed, and we need to run qualifications, get approval, etc. There are multiple nodes of these across our own manufacturing sites as well as external and that they all need to come online to get to where we need in terms of the full year guidance.
하지만 온라인 상태가 되거나 승인을 받을 각 노드에 대한 능력에 대한 자신감이 높아졌습니다. 일 년 내내 이런 일이 여러 번 있었습니다. 이런 일이 여러 번 발생했습니다. 제가 퀵펜을 한 가지 예로 들었듯이 어떤 것은 발생할 것입니다. 예를 들어 노스캐롤라이나의 콩코드 공장이 연말까지 가동되고 내년부터 제품을 볼 수 있을 것이라고 말한 것을 생각해보세요. 그 공사는 끝났습니다. 라인이 설치되었고 자격 검증, 승인 등을 거쳐야 합니다. 이러한 노드는 외부뿐만 아니라 자체 제조 현장에도 여러 개가 있으며, 연간 지침에 따라 필요한 곳에 도달하려면 모두 온라인 상태가 되어야 합니다.
But our confidence, as the year progresses, and as the year has progressed, our confidence in that has increased, but it remains the -- at least 1.5.
하지만 해가 거듭될수록, 그리고 해가 지날수록 이에 대한 자신감은 높아졌지만 여전히 1.5 정도에 머물러 있습니다.
'투자레터' 카테고리의 다른 글
| 주식 시장 사이클 이해하기 (1) | 2024.05.28 |
|---|---|
| AI 투자 시 전력이 부족한 이유와 해결 방안 (0) | 2024.05.28 |
| Union Pacific(UNP) 1Q24 Earnings Call (2) | 2024.05.02 |
| GE Vernova(GEV) 1Q24 Earnings Call (1) | 2024.05.02 |
| 스페이스X의 비밀 서평_브레드 버건 (0) | 2024.05.02 |
